Nitrogen isotope fractionation mechanism, analysis measurement tracer technology and its application in ecological environment
-
摘要:研究目的
氮(N)是地球陆地生态系统中的关键营养元素,也是引起水体富营养化的污染元素之一。随着分析测试技术的不断提高,氮稳定同位素技术已经发展成为一种常用的研究方法和分析手段,在氮的生物地球化学循环、水体富营养化和地下水污染来源识别等方面广泛应用。
研究方法本文查阅近年来国内外生态环境领域氮稳定同位素的相关文献,综述了氮同位素分馏机制、氮同位素分析技术以及氮同位素在生态环境中应用的研究现状。
研究结果(1)氮同位素质谱分析技术与氮同位素示踪技术目前已经建立了成熟体系。(2)硝化作用与反硝化作用是土壤氮转化循环的主要机制,生物固氮实现氮的输入,而植物或微生物产生含氮气体或矿化作用是氮输出的主要途径,并伴随着不同程度的氮同位素分馏效应。(3)氮同位素可以用来测定土壤氮素周转速率、N2O排放途径与生物固氮量、指示大气氮沉降变化、探究植物与土壤的相互作用及确定植物对氮素的吸收利用、识别农作物产地与水体、大气的氮污染来源。
结论未来应将研究重点放在提升氮循环过程中不确定性来源的定量检测能力,确定未被发现的氮输入、积累和损失途径,完善并发展生态系统氮循环模型。
创新点:(1)本文系统地总结了氮同位素分析测试技术原理和发展历史、氮同位素分馏机制及影响因素、氮元素地球化学循环与含氮污染物来源示踪的研究现状。(2)本文梳理归纳了国际上氮同位素在生态环境研究中,尤其是土壤−植物系统中的应用进展,并提出了未来的主要研究方向,为氮稳定同位素技术研发、拓展其应用提供参考。
Abstract:This paper is the result of environmental geological survey engineering.
ObjectiveNitrogen (N) is a key nutrient across Earth's terrestrial ecosystems and one of the pollution elements that cause water eutrophication. Owing to the continuous improvements of analysis and testing techniques, nitrogen stable isotope technology has developed into a common research method and analysis mean, and has been widely used in nitrogen biogeochemical cycle, water eutrophication and groundwater pollution source identification.
MethodsIn this paper, the relevant literatures on nitrogen stable isotope in the field of ecological environment domestic and overseas in recent years were reviewed, and the research status of nitrogen isotope fractionation mechanism, nitrogen stable isotope analysis technology and nitrogen isotope applications in ecological environment were summarized, the development of remediation technologys of nitrate pollution in groundwater were briefly described.
Results(1) A mature system of nitrogen isotope mass spectrometry and nitrogen isotope tracer technology has been established. (2) Nitrification and denitrification are the main mechanisms of soil nitrogen conversion cycle. Nitrogen input is realized by biological nitrogen fixation, and nitrogen output is mainly through nitrogen gas or ammoniation produced by plants or microorganisms, which is accompanied by different degrees of nitrogen isotope fractionation. (3) Nitrogen isotopes can be used to measure soil nitrogen turnover rates and N2O emission rates, improve biological nitrogen fixation, indicate changes in atmospheric nitrogen deposition, investigate the interaction between plant and soil and determine nitrogen uptake and utilization by plants, and identify crop area sources and pollution in groundwater and atmosphere.
ConclusionsFuture researches should focus on improving the ability of quantitative detection of uncertainty sources in the nitrogen cycle, identifying undiscovered nitrogen input, accumulation and loss pathways, and perfecting and developing ecosystem nitrogen cycle model.
Highlights:(1) This paper summarizes the principle and development history of nitrogen isotope analysis and testing techniques, the mechanism and influencing factors of nitrogen isotope fractionation, the research status of nitrogen geochemical cycle and the source tracing of nitrogen pollutants. (2) This paper composes and summarizes the international progress of nitrogen isotope application in ecological environment research, especially in soil−plant system, and proposes the main research directions for the future with the aim of providing references for the research and development of nitrogen stable isotope techniques and the expansion of its applications.
-
1. 引 言
地球上最大的氮储库是大气,近地表环境中约99%的氮以大气氮气或水体中溶解态的形式存在。只有一小部分氮与碳、氧等元素结合,对生命过程起着决定性的作用(Hoefs, 2021)。大气、陆地和水生生态系统之间大量氮流动促进了地球上的氮循环(Tao et al., 2019)。大气中的氮可以被细菌和藻类转化为有效氮,如铵态氮、硝态氮以及氨基态氮。微生物在土壤和水圈中的氮循环起到关键作用,包括固氮、硝化和反硝化、氨化过程。其他细菌将不同形式氮以N2的形式返回到大气中(Hoefs, 2021)。
氮有两种稳定同位素14N和15N,其同位素丰度为:14N 99.63%,15N 0.37%。氮同位素的δ值用 δ15N表示:
δ15N(‰)=[(Rsample/Rstandard)−1]×1000 (1) 式中:δ15N为样品的Rsample值与标注样Rstandard值的千分偏差,R为15N/14N比值。通常选取大气氮同位素比值作为标准样,大气氮同位素比值15N/14N=3676.5±10−6。在生物或地球化学过程中,两种氮同位素的质量差异导致其发生分馏效应。微生物驱动的氮循环中不同过程有不同的同位素分馏特征(郑永飞和陈江峰,2000),利用各个过程不同的同位素分馏特征可以示踪含氮物质的来源、转化和迁移等。
氮同位素应用领域广泛。在氮的生物地球化学循环中,通过测定土壤与植物中的氮同位素组成,可以估算土壤氮素周转速率与生物固氮率,判别土壤N2O产生途径;通过比较不同植物的氮同位素组成,可以获取氮偏好、土壤氮源的供应情况以及农作物产地等生态学信息。此外,农业生产等人类活动使得过量的氮以硝酸盐、氨或水溶性有机氮等形式输入陆地生态系统,并导致森林退化、土壤酸化和生物多样性改变等。含氮化合物还会通过地表径流进入水体导致地表水富营养化、酸化,最终导致有害的藻类大量繁殖和生物多样性被破坏(Hastings et al., 2013),或通过向下渗透进入地下水导致地下水硝酸盐污染等。使用氮同位素示踪技术可以识别各生态环境中氮污染来源,为减轻过量氮对环境产生的负面影响提供科学依据。
2. 氮同位素分馏机制
氮同位素分馏分为动力学分馏和平衡分馏两大类,其中前者以生物作用为主,包括氮循环转化过程中的生物固氮作用、同化作用、矿化作用、硝化作用和反硝化作用;后者则以非生物作用为主。其中,固氮作用、同化作用、矿化作用等过程产生的分馏较小,而硝化作用、反硝化作用则是影响水土环境中氮同位素组成变化最直接和最重要的过程,产生的同位素分馏显著(谢先军,2019)。
氮同位素分馏主要发生在氮的表生地球化学循环过程中。土壤氮循环过程可以分为氮的输入、转化和输出,微生物起着关键作用,这些过程中均发生着不同程度的氮同位素分馏效应(图1)。
![]() 图 1 主要氮循环过程中的同位素分馏效应(ε,δ15N/‰)(据张金波等,2022)Figure 1. Isotopic fractionation in major nitrogen cycles (ε, δ15N/‰) (after Zhang Jinbo et al., 2022)
图 1 主要氮循环过程中的同位素分馏效应(ε,δ15N/‰)(据张金波等,2022)Figure 1. Isotopic fractionation in major nitrogen cycles (ε, δ15N/‰) (after Zhang Jinbo et al., 2022)2.1 固氮作用
自然条件下,生物固氮是土壤氮的输入过程,指的是大气中的氮气在微生物体内由固氮酶催化还原为氨的过程:
N2+3H2O→2NH3+3/2O2 (2) 固氮过程氮同位素分馏较小,通常产生δ15N值略小于0‰的有机物质,变化范围为−3‰~+2‰。
2.2 同化作用
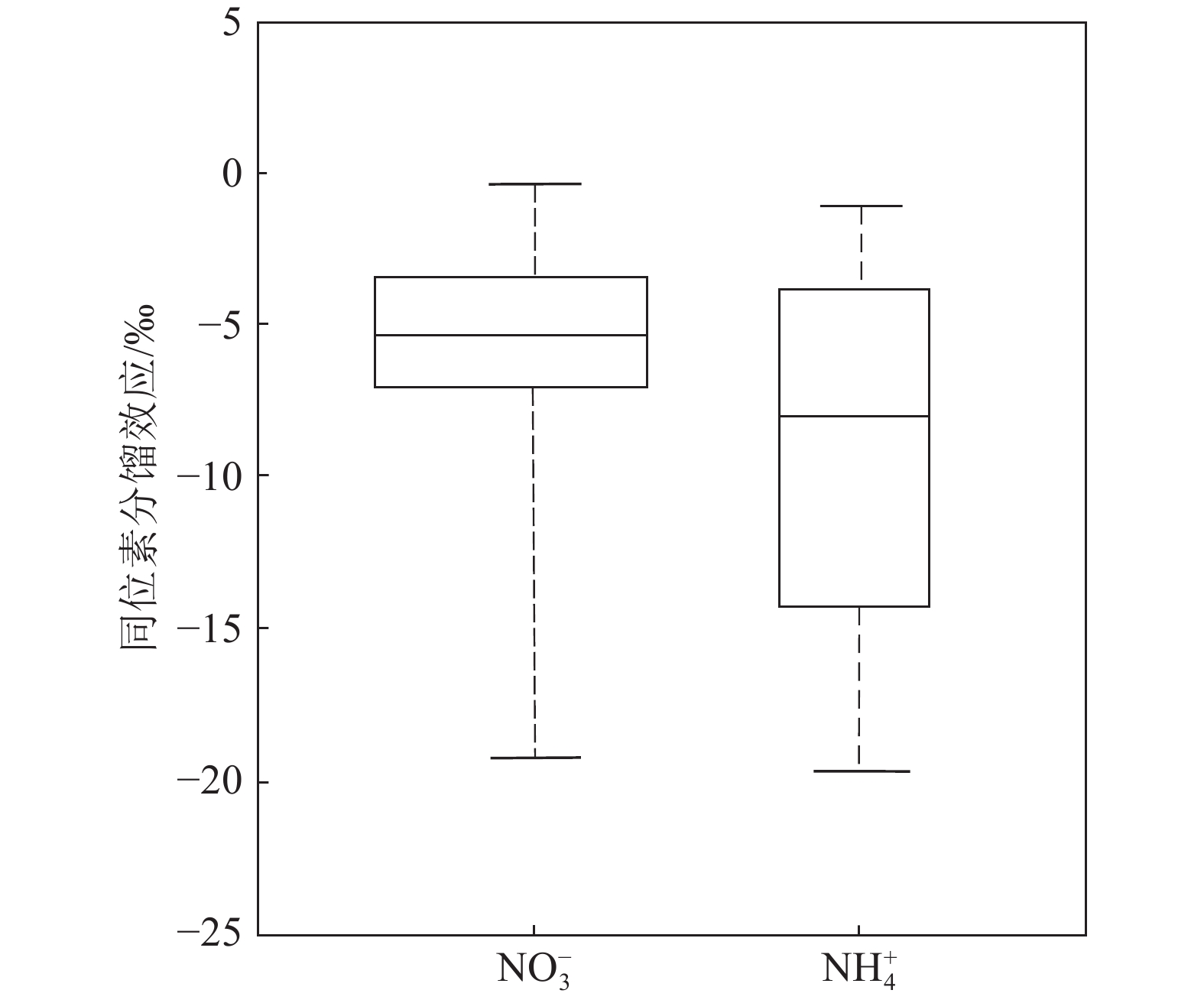
同化作用是指植物和微生物吸收无机态氮转化为有机态氮的过程。同化作用通常优先吸收同化14N化合物(Waser et al., 1998),使得生物体较无机氮化合物贫15N。已有研究发现微生物和植物吸收NO3−的同位素分馏效应平均值为(−5.9±3.7)‰;吸收NH4+的同位素分馏效应平均值为(−9.4±6.6)‰(Denk et al., 2017),总体而言,生物体吸收NH4+过程产生的同位素分馏相对NO3−略显著(图2)。
2.3 矿化作用
矿化作用是微生物分解有机氮转化为NH3的过程,又称氨化作用。矿化作用释出的氨大部分与有机或无机酸结合成铵盐,或被植物吸收,或在微生物作用下氧化成硝酸盐(谢先军,2019)。
矿化作用形成的铵盐比原来的有机氮贫15N。土壤培养实验表明,矿化形成的NH4+的δ15N值要比原来的有机氮降低5‰~7‰。Kendall(1998)认为,受硝化作用的影响,矿化作用通常在土壤有机质中引起较小的分馏(±1‰)。
2.4 硝化作用
硝化作用是指微生物作用下氨氮氧化为硝酸盐氮的过程。一般分三个步骤:
有机氮 ①→NH+4②→NO−2③→NO3 (3) 硝化作用分为自养和异养两个过程。自养硝化作用是指通常以无机物作碳源,不需要特定有机碳源就能进行的硝化过程,它利用无机物作为电子供体,并通过这种方式获取能量。相比之下,异养硝化作用是依赖于特定的有机碳源,并且其过程涉及有机物转化和能量释放的硝化过程(Bai et al., 2022)。
在有机氮转化为氨氮的过程中,几乎无氮同位素分馏。而在氨氮氧化为硝酸盐氮过程中,通常伴有显著的动力学分馏。硝化作用中氮同位素的总分馏程度取决于硝化作用反应速率控制步骤。如有大量的NH3存在,②或②和③是速率控制步骤,形成产物通常比初始物质亏20‰~35‰的δ15N(李思亮等,2002),土壤中有机氮转化为NH3的速率缓慢,此时①为速率控制步骤,不存在氮同位素分馏,所生成硝酸盐的氮同位素组成与其有机氮源氮同位素组成相同(Denk et al., 2017)。
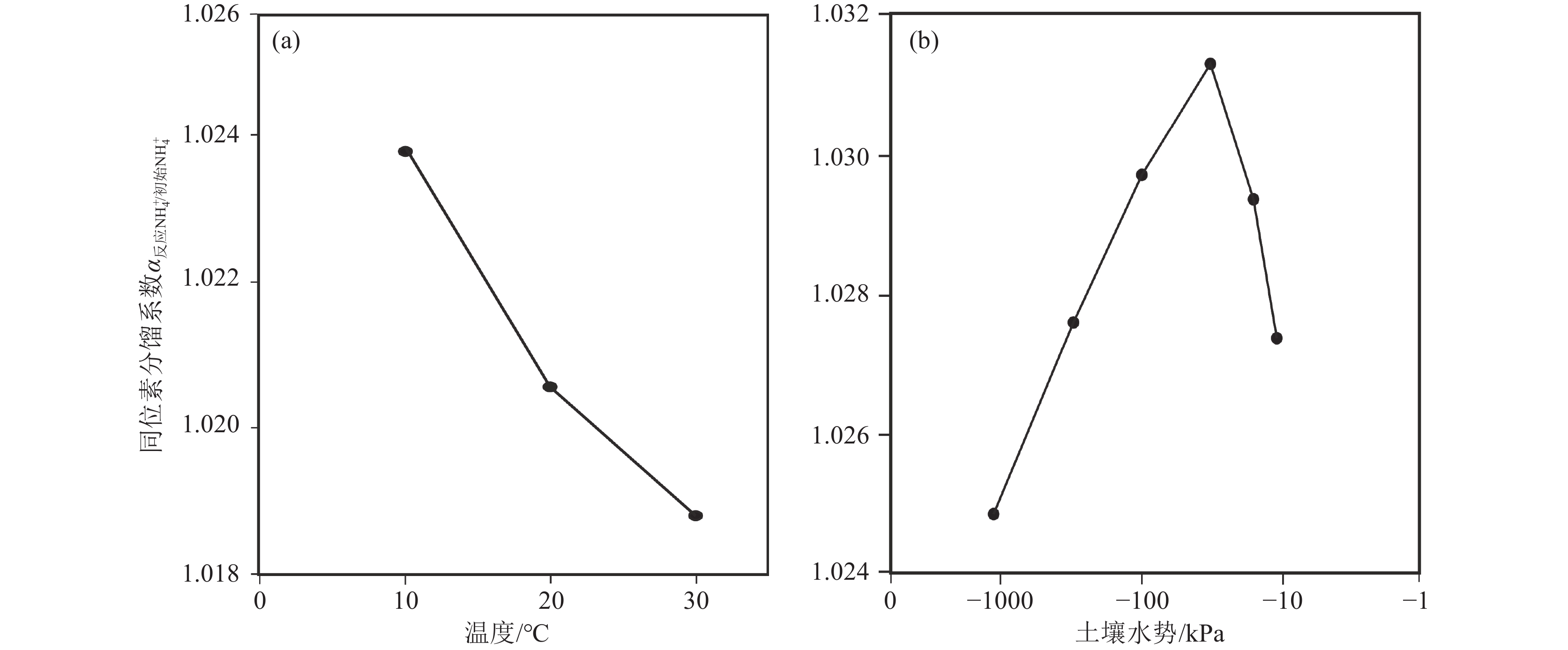
硝化作用的速率与氮同位素分馏程度主要与温度和湿度有关。在Yun et al.(2011)的研究中,温度的升高增加了硝化速率,降低了氮同位素分馏程度(图3a),并确定了10℃、20℃、30℃下硝化过程氮同位素富集系数分别为−18.3‰、 −20.1‰和−23.2‰。Choi and Ro(2003)等研究得到饱和、非饱和土壤中硝化过程氮同位素富集系数分别为−10‰和−40‰。Yun and Ro(2014)研究指出,硝化速率随土壤水分的增加而增加,氮同位素分馏程度随着土壤水分的增加呈现出先增加后减小的趋势(图3b),这是因为土壤水分可以调节微生物体内NH4+浓度,影响NH4+的运输,这种变化可能影响硝化作用氮同位素分馏程度。然而,硝化作用往往伴随氨的挥发,Lu et al.(2021)研究发现在硝化过程中,较弱的挥发性和较强的氮固定和矿化作用会降低氮同位素分馏效应。
![]() Figure 3. Changes of nitrogen isotope fractionation coefficient in soil nitrification process under the influence of temperature (a, after Yun et al., 2011) and humidity (b, after Yun and Ro, 2014)
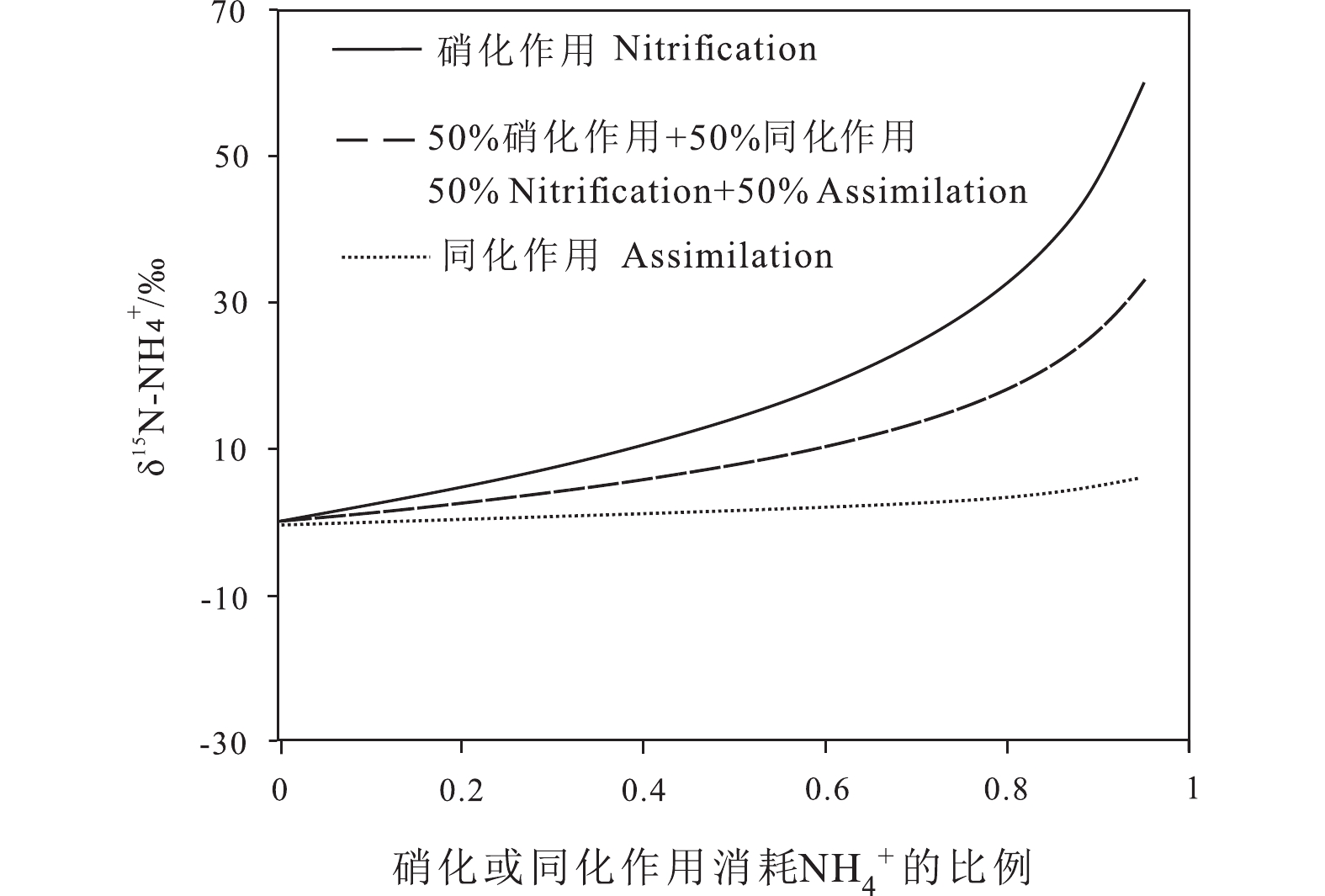
Figure 3. Changes of nitrogen isotope fractionation coefficient in soil nitrification process under the influence of temperature (a, after Yun et al., 2011) and humidity (b, after Yun and Ro, 2014)氮转换过程既不是封闭的,也不是单向的,通常为两个以上不同的过程同时发生,因此每个氮转化过程中氮同位素分馏程度还取决于每个过程中基质消耗氮贡献。NH4+同时受到硝化和同化作用的影响,这两个过程会竞争NH4+。由于硝化作用比同化作用引起更大的同位素分馏,NH4+的δ15N高度依赖于硝化和同化作用对NH4+消耗的相对贡献,即硝化作用占NH4+消耗的比例越大,NH4+的δ15N越高,反之亦然(图4)。
![]() 图 4 δ15N−NH4+随NH4+受硝化作用和同化作用影响的变化(据Choi et al., 2017)Figure 4. Change of δ15N−NH4+ as NH4+ is affected by the contribution of nitrification and assimilation (after Choi et al., 2017)
图 4 δ15N−NH4+随NH4+受硝化作用和同化作用影响的变化(据Choi et al., 2017)Figure 4. Change of δ15N−NH4+ as NH4+ is affected by the contribution of nitrification and assimilation (after Choi et al., 2017)2.5 反硝化作用
反硝化作用是厌氧环境下细菌将硝酸盐还原为氮气的过程:
NO−3→NO−2→NO→N2O→N2 (4) 绝大多数反硝化微生物都是异养型细菌,以有机碳作为电子供体,在厌氧条件下,以NO3−作为电子受体,将NO3−还原为N2。少数反硝化微生物为自养型细菌,以还原性无机组分如Mn2+、Fe2+和HS−作为电子供体将NO3−还原为N2。
反硝化过程涉及一系列与N−O键破裂有关的反应,伴随显著同位素分馏。残留在体系中的NO3−比反硝化产物明显富集15N,其富集系数通常介于5‰~40‰(Fukada et al., 2003)。反硝化作用分馏程度受细菌代谢的实验条件所控制,不同学者在不同条件下得到的分馏系数差异很大(表1),说明在反硝化过程中影响氮同位素分馏的因素很多,如微生物种类与数量、温度、NO3−浓度等。
表 1 不同细菌在不同实验条件下反硝化作用的氮同位素分馏效应(ε,δ 15N/‰)Table 1. Nitrogen isotope fractionation effect of denitrification by different bacteria under different experimental conditions (ε, δ 15N/‰)Frey et al.(2014)和Treibergs and Granger(2017)在不同条件下测定了脱氮副球菌与硫单胞菌反硝化作用的氮同位素分馏效应(表2),由实验结果可以看出,在其他条件不变的情况下,细菌反硝化作用氮同位素分馏程度随温度、NO3−浓度和细菌数量的升高而增大。
Table 2. Nitrogen isotope fractionation effect of denitrification by the same bacteria under different experimental conditions (ε, δ 15N/‰) (after Frey et al., 2014; Treibergs and Granger, 2017)细菌 温度/
℃NO3−浓度/
mM细菌数量/
个氮同位素分馏效应
(ε,δ 15N/‰)脱氮副球菌 20 0.2 4 22.90 20 0.2 4 25.80 20 1 3 33.00 20 1 5 31.50 硫单胞菌 15 5 5 24.29 15 5 4 21.17 15 1 5 17.69 10 1 5 13.08 10 1 5 13.08 不同生态系统反硝化作用的氮同位素分馏效应也存在明显差异(表3)。森林土壤反硝化过程中产生的氮同位素分馏效应远高于其他环境条件,如荒漠、湿地、淡水、地下水和沉积物,农田土壤反硝化过程中氮同位素分馏效应的变化范围相较其他环境条件显著。
表 3 不同生态系统反硝化作用氮同位素分馏效应Table 3. Denitrification effect of nitrogen isotope fractionation in different ecosystems3. 氮同位素分析测试与示踪技术
3.1 氮同位素质谱分析技术
长期以来,针对生态系统氮循环的需要,人们开展了氮同位素分析测试技术研究。1831年科学家利用杜马斯(Dumas)燃烧法把固体样品转化成N2, 实现氮稳定同位素在线测定;1939年列敦伯尔格提出了利用湿氧化的方法测定样品中氮同位素比值(Rittenberg et al., 1939);1950年有学者继续应用15N进行示踪实验,并用质谱仪测定样品中的15N丰度(曹亚澄等,2018)。20世纪60年代中期,中国建立了15N质谱分析方法(尤崇杓等,1965)。自21世纪开始, 实现了通过化学或者生物的方法将溶液中的含氮物质直接转化成待测气体,再利用同位素质谱仪进行在线同位素的测定(Liu et al., 2017)。
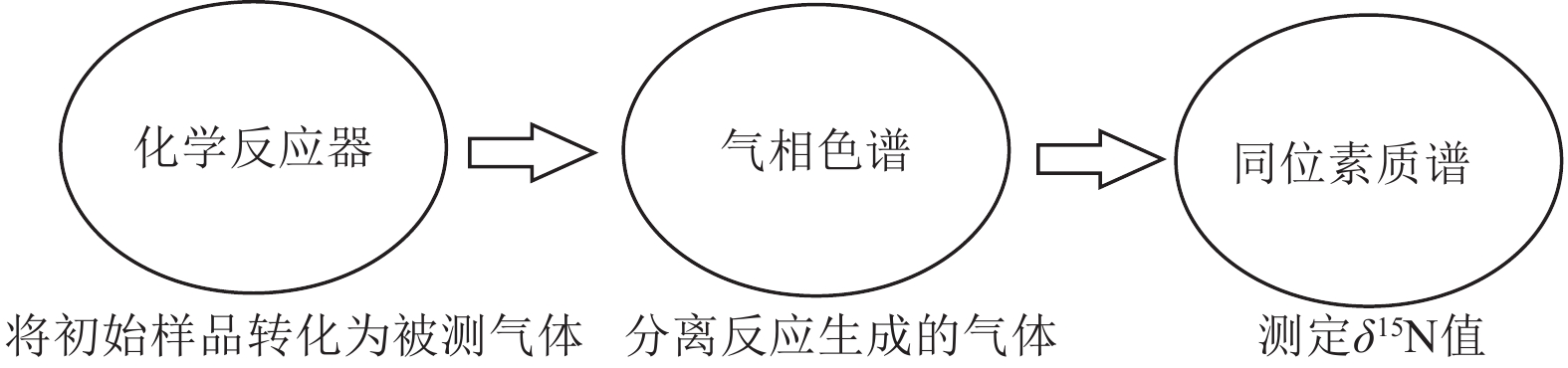
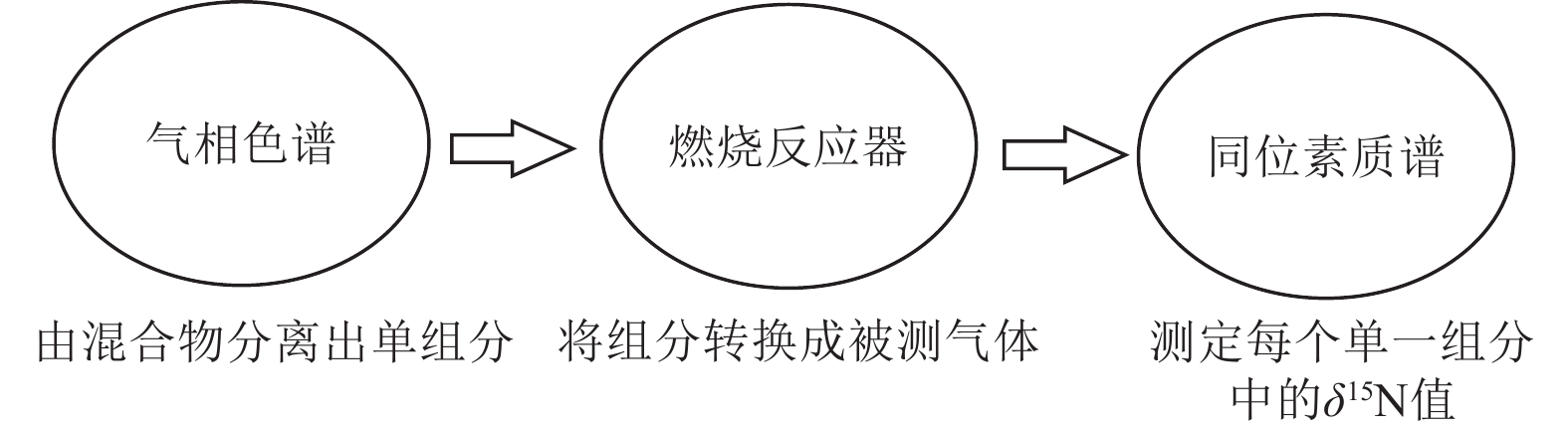
元素分析−同位素质谱仪(EA−IRMS)是在生态环境研究领域使用较为普遍的技术,最常用的是一种自动碳、氮分析−同位素质谱仪。首先将干燥和细磨的土壤、植物或沉积物样品在化学反应装置中转化成能被分析的气体,如N2或N2O,然后由气相色谱柱分离上述反应生成的气体,最后再用同位素质谱仪测定氮同位素比值(图5)。
自21世纪开始,科学家进一步发展了测定可溶性有机和无机氮的同位素组成快速分析技术,利用气相色谱同位素比质谱仪进行在线同位素测定(GC−IRMS)(Liu et al., 2017)。将氮气、氦气或其他惰性气体以一定的流量通过液体或固体进行吹扫,吹出待测分析的痕量挥发性组分后,被冷阱中的吸附剂所吸附,然后加热脱附进入气相色谱系统进行分析(图6)。
3.2 氮同位素示踪技术
氮同位素示踪技术主要包括氮同位素标记技术与氮同位自然丰度技术两类。进入21世纪后,氮同位素示踪技术作为一种了解生态系统中物质循环和能量转换过程的工具,在生态学、环境科学和农学等相关领域得到了广泛应用。
3.2.1 氮同位素标记技术
氮同位素标记技术是将一定丰度的15N含氮化合物添加到植物、土壤或整个生态系统当中, 经过一段时间后分析其去向(Templer et al., 2012)。20世纪30年代末,Rittenberg et al.(1939)首次应用15N标记技术研究生物固氮作用;20世纪40—60年代是15N标记技术的迅速发展时期,但因15N标记技术存在的缺点限制了其推广应用:标记的含氮化合物很难均匀扩散到植物、土壤等各系统中, 无法保证新加入的标记物与系统本身含氮化合物混合均匀(Groffman et al., 2006)。除此之外,新加入的标记含氮化合物增加了土壤原有的底物浓度, 会显著影响一些氮源缺乏的生态系统中含氮气体的排放速率, 进而高估所测定的土壤含氮气体排放速率。因此15N标记法主要应用于氮素含量较高的生态系统, 如农田生态系统(张志君等,2018)。
氮同位素标记技术主要分为贫化氮同位素标记技术与富集氮同位素标记技术(图7)。富集氮同位素标记技术就是将某一形态的N库用15N标记后,当其他未标记N形态转化成为标记N形态时,使该N库中的l5N丰度下降;相反,当标记N向其他形态转化时,使转化生成的N库中15N丰度提高。利用15N的稀释和富集,结合各形态氮库的含量变化可以研究土壤氮素转化速率、土壤N2O产生途径以及生物固氮等研究(Yang et al., 2014; Li et al., 2019; Zhu et al., 2019)。
贫化氮同位素标记技术以氮同位素含量低于自然丰度的物质作为标记物,有学者已经从某种贫化15N的硫酸铵检测到15N丰度为0.0513原子百分超,即15N自然丰度与其的差值。然而贫化氮同位素物质与自然丰度物质在同位素含量差异较小,在实际操作过程中易被自然丰度物质快速稀释而失去标记特征,因此在应用当中具有一定局限性。富集氮同位素标记技术选择氮同位素丰度高于自然丰度值的物质作为标记物,目前人工浓集方法已经可以将氮同位素富集丰度达到99原子百分超(曹亚澄等,2018)。
3.2.2 氮同位素自然丰度技术
氮同位素自然丰度技术的原理是氮同位素之间存在质量差异使得氮循环过程中产生同位素分馏效应,导致氮同位素的自然丰度发生可测量的变化。20世纪70—80年代,科学家发展了15N自然丰度法(曹亚澄等,2018),以大气中15N丰度作为15N的标准自然丰度值,测定氮素循环过程中的氮同位素分馏、研究植物吸收不同形态氮的比例、评估生态系统氮状态、量化生物固氮速率。15N自然丰度法适用于大面积区域的对比研究且不受时间空间的限制,因此,被越来越多地应用于氮沉降对森林生态系统氮循环的影响研究中(姚凡云等, 2015)。
通常将空气中氮气的自然丰度(0.3663 atom%)作为氮同位素15N的自然丰度;也可以将示踪实验使用的同位素标记物质或采集到的同类样品(土壤或者植物)的同位素丰度值作为自然丰度;从富集同位素样品的丰度中扣除自然丰度的原子百分数值(即样品同位素的原子百分超)(张金波等,2022)。氮同位素自然丰度变异作为生物圈物质循环过程的特征标记,已经被广泛地用于研究土壤氮循环、植被与气候变化等相关领域,除此之外,氮同位素自然丰度变异还可以指示氮污染源。
4. 氮同位素在土壤和植物氮循环中的应用
4.1 土壤氮素周转速率
土壤氮的迁移转化主要取决于氮的存在形式。各种形态氮的转化主要受土壤氮矿化和硝化速率控制(Zhang et al., 2018)。矿化作用将土壤有机氮转化为无机氮,是氮转化过程中最关键的步骤,它为硝化、反硝化等其他土壤氮循环过程提供底物,决定了土壤氮的可利用性和陆地初级生产力(Kuypers et al., 2018);硝化作用是生态系统中氮转化的重要途径,产生影响净初级生产力的硝酸盐,既可以增加植物氮的有效性,还可以增加N2O的排放。不同环境条件、土壤类型等会对土壤中氮素的周转速率和特征产生影响,从而影响植物对氮素的吸收和利用(Chen et al., 2019)。
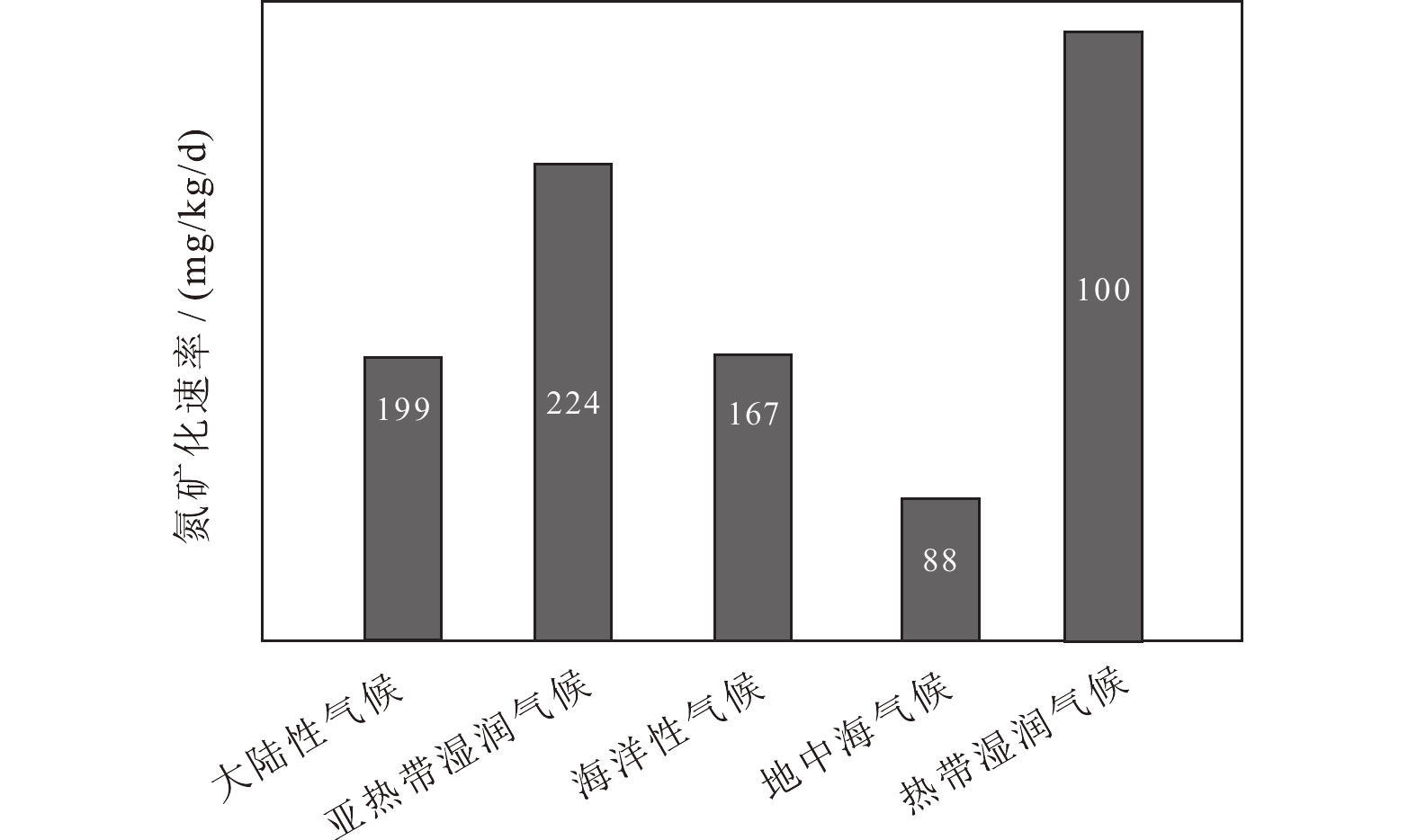
土壤总氮含量与微生物量是土壤氮周转速率的驱动因素,雨热条件和土壤理化指标则不同程度地影响着土壤氮周转速率。Liu et al.(2016a)和Li et al.(2020)整理了利用15N标记技术研究土壤氮周转速率的文献资料,发现土壤氮周转速率具有明显的纬向格局,随纬度增加呈下降趋势,说明年平均气温是影响氮矿化作用的影响因素,温暖和多雨环境加速了矿化速率。Zhang et al.(2018)报道,热带湿润地区土壤氮矿化速率显著大于其他地区(图8),没有发现温度对硝化作用的一致规律性影响,Gao and Yan(2019)研究表明,全球变暖降低了7%的土壤硝化速率,而其他研究发现,变暖大大增加了硝化速率(Bork et al., 2019)
![]() 图 8 不同气候带土壤氮矿化速率白色数字为观测个数(据Elrys et al., 2021)Figure 8. Soil nitrogen mineralization rates in different climatic zoneWhite numbers are the number of observations (after Elrys et al., 2021)
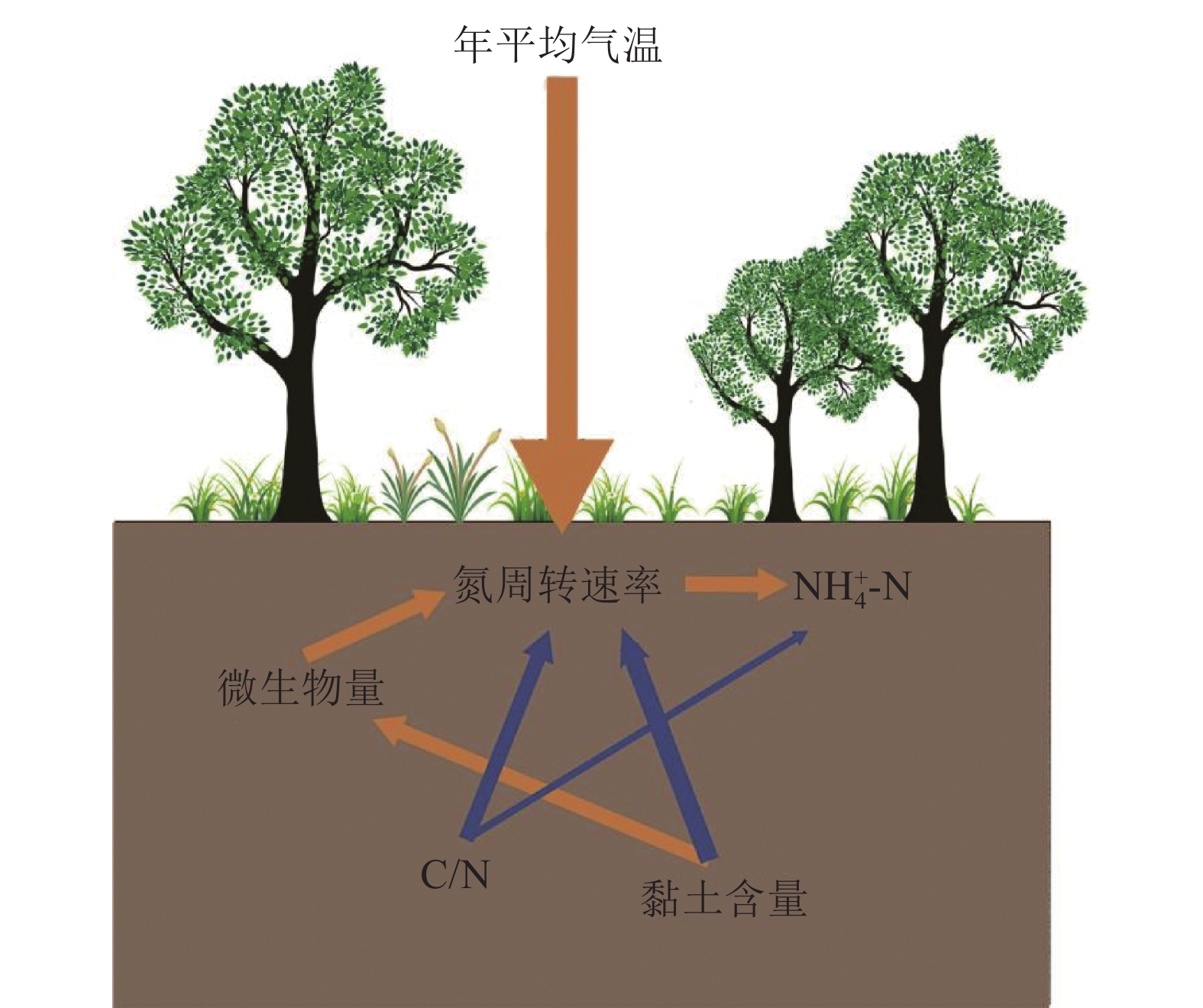
图 8 不同气候带土壤氮矿化速率白色数字为观测个数(据Elrys et al., 2021)Figure 8. Soil nitrogen mineralization rates in different climatic zoneWhite numbers are the number of observations (after Elrys et al., 2021)土壤pH是微生物群落组成的主要决定因素,在一定范围内提高pH可以增强土壤微生物群落活动,而土壤微生物群落在营养物质分解过程中发挥着重要作用,进而影响土壤矿化速率(Kemmitt et al., 2006)。土壤pH对硝化速率也有重要影响,在一定范围内pH的提高对总硝化速率具有积极影响,pH<4.3时硝化速率降低,当pH在7.0~9.0是硝化速率最适范围(刘君政,2019)。Zhang et al.(2016a)采用15N示踪模型计算土壤氮周转速率,认为土壤高的C/N对其有抑制作用(图9),C/N高的土壤为微生物提供充足的碳源,而微生物活性主要受氮限制,矿化产生的氮迅速被固持来满足微生物的需求(毛超和漆良华,2015)。黏土对土壤有机质具有较强的物理保护作用,因此黏土中土壤氮的矿化速率要低于砂土等其他土壤质地(Skjemstad et al., 1999)。
![]() 图 9 土壤氮周转速率影响因素橙色箭头代表正相关,蓝色箭头代表负相关,箭头越粗表明相关性越大(据Li et al., 2020修改)Figure 9. Factors affecting soil nitrogen turnover rateThe orange arrow represents a positive correlation, the blue arrow represents a negative correlation, and the thicker the arrow, the greater the correlation (modified from Li et al., 2020)
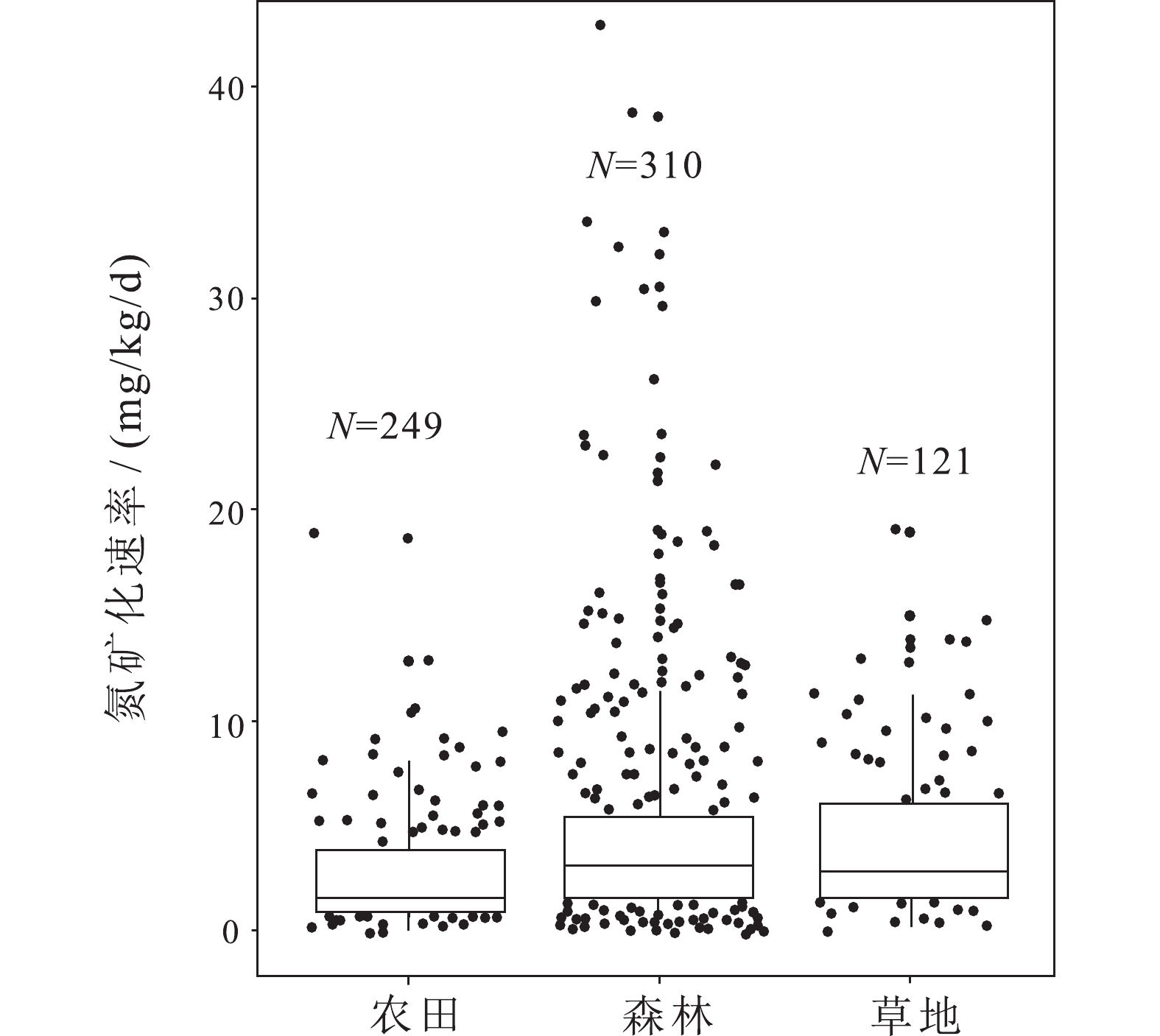
图 9 土壤氮周转速率影响因素橙色箭头代表正相关,蓝色箭头代表负相关,箭头越粗表明相关性越大(据Li et al., 2020修改)Figure 9. Factors affecting soil nitrogen turnover rateThe orange arrow represents a positive correlation, the blue arrow represents a negative correlation, and the thicker the arrow, the greater the correlation (modified from Li et al., 2020)土壤氮周转速率及其驱动因子随生态系统类型的不同变化很大。Booth et al.(2005)总结了来自各种生态系统的近300种不同土壤的δ15N测定结果,发现森林(3.97 mg/kg/d)和草地(7.34 mg/kg/d)土壤的氮矿化速率高于林地和农田(1.76 mg/kg/d),与Elrys et al.(2021)的研究结果一致(图10)。森林和草原土壤中较高含氮有机质含量是矿化速率较高的原因之一(Lang et al., 2019),森林生态系统中植被类型是氮矿化速率的主要控制因素,Wang et al.(2016)以99.2 atom%的15N分别标记不同森林土壤中NH4+与NO3−,测得次生阔叶林土壤氮矿化速率明显高于原生草原与针叶林土壤。而农田土壤低氮矿化速率归因于农业活动破坏了土壤结构,增强土壤通气,加速含氮有机质分解,并且在耕作条件下,微生物量减少37%~50%。此外,高无机氮输入抑制土壤微生物产生腐殖质降解酶,从而降低氮矿化速率(Elrys et al., 2021)。
![]() 图 10 不同生态系统氮矿化速率(N为观测值个数;据Elrys et al., 2021)Figure 10. Nitrogen mineralization rate in different ecosystems (N is the number of observations; after Elrys et al., 2021)
图 10 不同生态系统氮矿化速率(N为观测值个数;据Elrys et al., 2021)Figure 10. Nitrogen mineralization rate in different ecosystems (N is the number of observations; after Elrys et al., 2021)Li et al.(2020)综合了全球范围内不同生态系统15N标记的观测数据进行综合,发现农田土壤的平均硝化速率高于草地和森林(表4),显然,农田硝化速率、矿化速率与草地和森林的关系恰恰相反,但与湿地的差异并不显著,在自然生态系统中,草地土壤硝化速率最低。C/N是驱动草地和森林土壤硝化速率的关键因子,与农田相比,森林和草地中显著较高的C/N增加了微生物对氮的需求,导致土壤氮有效性降低,从而降低了硝化速率(Chen et al., 2015)。土壤pH值是农田土壤硝化速率的主要驱动因子,pH值与农田土壤硝化速率的正相关性可能是由于长期施用氮肥影响土壤pH值变化,增加了氨氧化细菌的丰度和活性,刺激硝化作用的发生(Cookson et al., 2007)。
表 4 不同生态系统平均硝化速率(据Li et al., 2020)Table 4. Average nitrification rate in different ecosystems (after Li et al., 2020)生态系统 平均硝化速率/(mg/kg/d) 观测数据/个 农田 3.82 1423 森林 2.58 841 草地 1.70 368 湿地 3.29 80 迄今为止,陆地生态系统中有关硝酸盐异化还原成铵(DNRA)(式5)与反硝化作用的研究较少。
NO−3→NO−2→NH+4 (5) Chen et al.(2015)研究认为DNRA速率可以与反硝化速率相当甚至高很多倍,然而关于硝酸盐异化还原成铵作用的环境控制以及这一过程在生物气候带和土壤类型的广泛程度仍然存在问题。
4.2 土壤N2O产生途径及影响因素
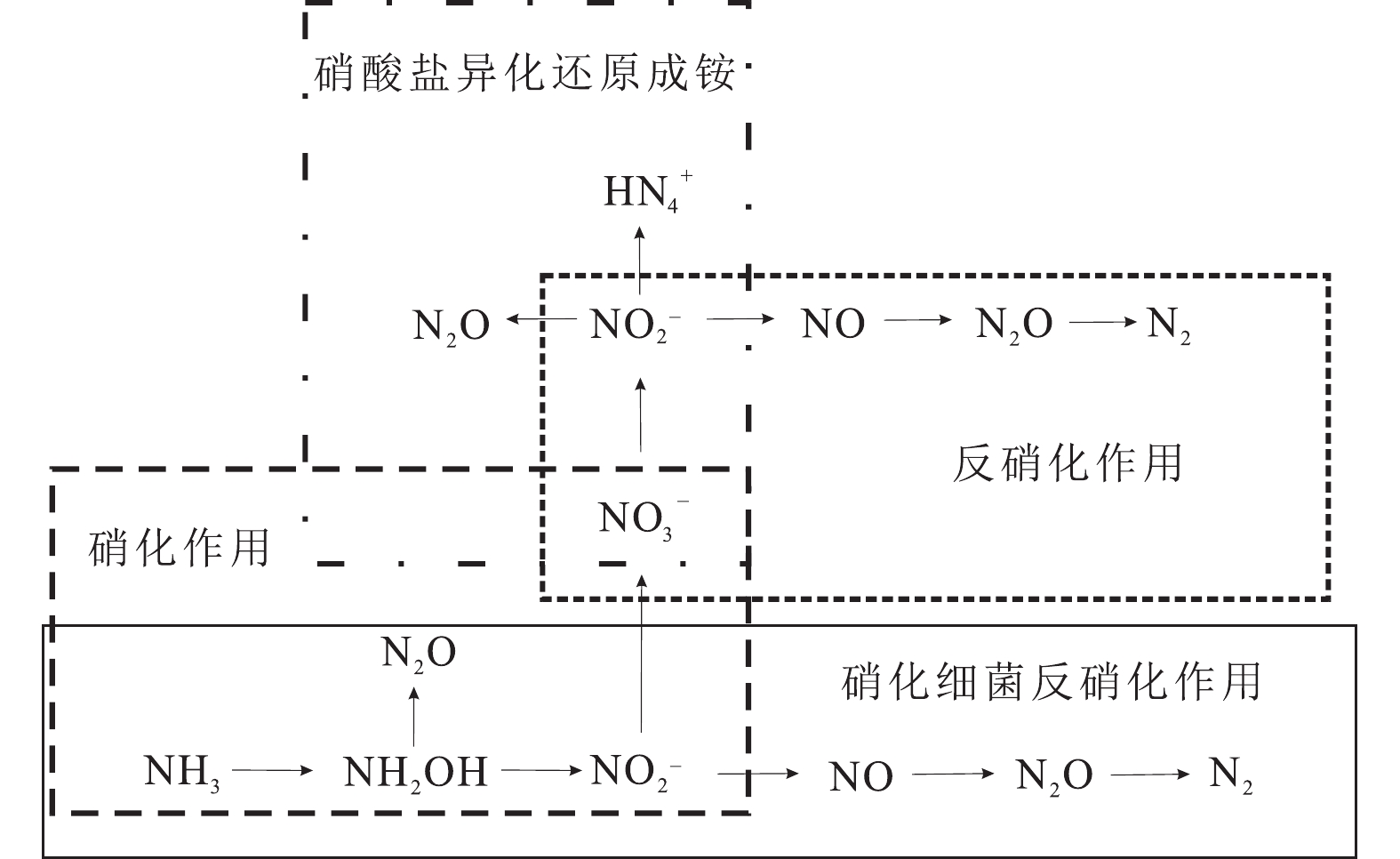
氧化亚氮(N2O)的排放是土壤氮周转的结果。土壤可以通过硝化作用、反硝化作用、硝酸盐还原作用、硝化细菌反硝化作用等几种途径产生N2O(图11)(Wrage−Mönnig et al., 2018),其中硝化作用与反硝化作用是N2O产生的主要驱动因素(Liu et al., 2016b)。δ15N可以有效区分硝化和反硝化作用(Zhang et al., 2015b)。使用15N分别标记15NO3−和15NH4+,测定实验过程中NO3−、NH4+、土壤有机氮和产生N2O的15N丰度,可以量化N2O产生过程中各个来源的贡献。土壤产生N2O的15N取决于有效氮(NH4+和NO3−)的15N含量、微生物种类、土壤孔隙水含量、pH和温度(Denk et al., 2017)。
![]() 图 11 土壤N2O产生途径(据Baggs, 2008)Figure 11. The process of soil N2O production (after Baggs, 2008)
图 11 土壤N2O产生途径(据Baggs, 2008)Figure 11. The process of soil N2O production (after Baggs, 2008)微生物种类是影响N2O的产生途径的决定因素。N2O分子为不对称的直线型结构,其分子式为N=N=O,中间和边缘不同的氮原子被分别称为α原子和β原子。N所处位置不同,在同位素分析中其测量值也不同,这种不同位置嗜好性产生的差值称为点位优势值(Site preference),简称 SP(林伟等,2017)。本文统计了前人对不同微生物产生N2O过程分子间15N位点优势值的测定结果(表5),认为通过N2O分子中SP值可以判别两个N2O产生途径,一部分为细菌氧化作用和真菌反硝化作用产生的N2O过程,另一部分为硝化细菌反硝化作用产生的N2O过程(Buchen et al., 2018)。
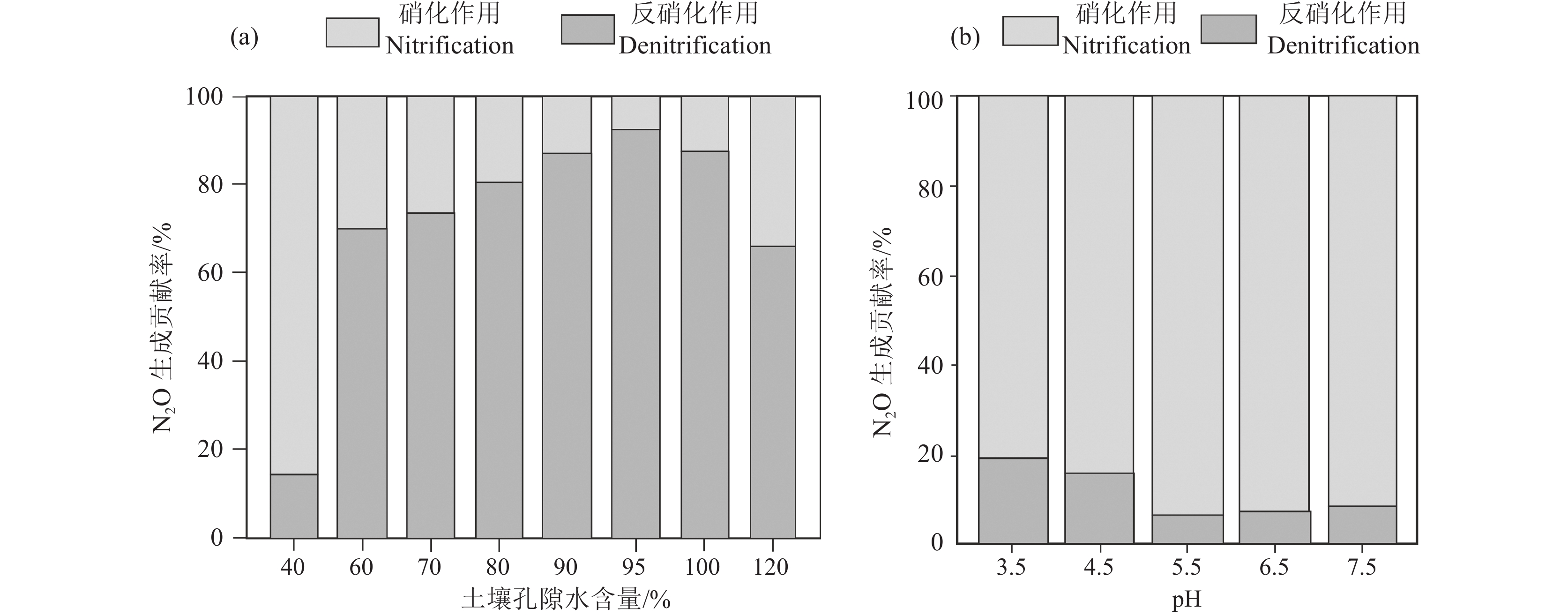
表 5 不同N2O产生过程中δ15N与SP值(据Decock and Six, 2013)Table 5. Different N2O production processes of δ15N and SP values (after Decock and Six, 2013)N2O产生过程 δ15N/‰ SP 氨氧化细菌羟氨氧化 −0.3±3.4 33.0±1.6 甲烷氧化菌羟氨氧化 1.9±1.9 32.7±5.0 氨氧化细菌氨氧化 −45.5±2.3 31.4±4.2 非生物氧化 −5.8±9.2 29.9±1.5 真菌反硝化作用 −9.9±6.7 35.2±4.3 反硝化作用 −13.8±4.9 −2.2±3.2 硝化细菌反硝化作用 −29.0±6.0 −1.0±4.3 土壤理化性质和温度是影响N2O产生途径的主要因素。土壤孔隙水含量被广泛用作土壤湿度的指标,研究表明土壤孔隙水处于35%~70%时有利于硝化和反硝化作用的发生(Huang et al., 2014)。Wang et al.(2023)利用15N标记法量化不同途径产生的N2O,发现较低的土壤孔隙水含量更有利于硝化作用的发生(图12a),因为硝化细菌是专性好氧菌,较反硝化细菌更强烈地消耗15N,低氧水平降低它们的硝化效率(Martínez−Espinosa et al., 2021)。除土壤孔隙水含量外,硝化和反硝化过程对土壤pH也非常敏感(Hu et al., 2014),真菌较细菌可以在更广泛的pH值范围内生长,尤其是酸性条件。因此,酸性环境可能给真菌带来竞争优势,对土壤反硝化作用产生N2O的贡献更大(Kaushal et al., 2022),Zhang et al.(2021)利用15N标记技术量化硝化和反硝化作用分别对N2O生成的贡献率,也证实了这一观点(图12b)。
![]() Figure 12. Effects of soil water filled pore space (a, after Wang et al., 2023) and pH (b, after Zhang et al., 2021) on the contribution of nitrification and denitrification to N2O production
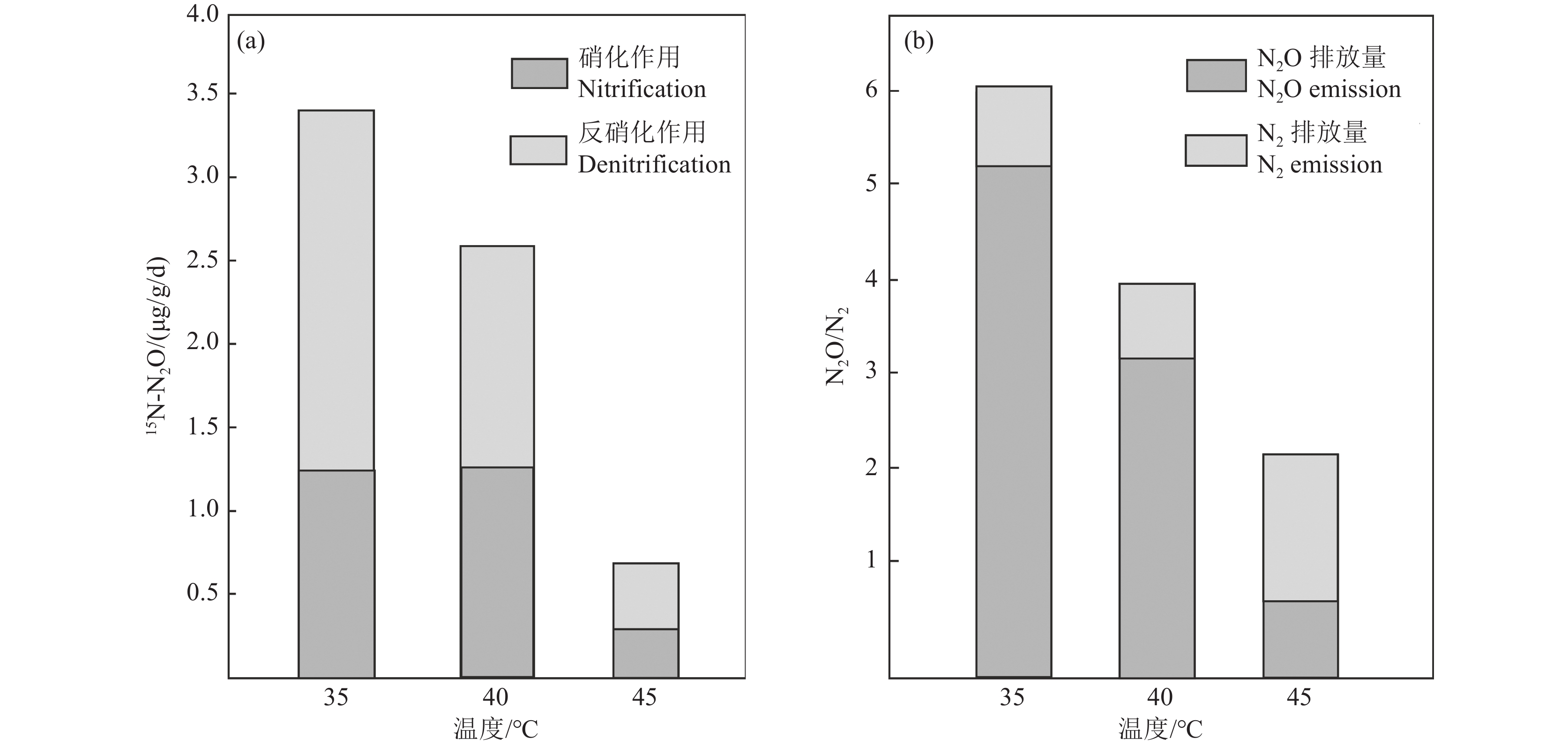
Figure 12. Effects of soil water filled pore space (a, after Wang et al., 2023) and pH (b, after Zhang et al., 2021) on the contribution of nitrification and denitrification to N2O production温度升高影响土壤有机质有效性、土壤水分、微生物生长等,这会导致土壤N2O排放形式发生变化。Lai et al.(2019)测定35°~45 °C温度下土壤15N−N2O,发现超过35 °C土壤N2O排放量逐渐减少,35~40 °C硝化作用产生的N2O比例增大(图13a),这是由于异养硝化细菌在温暖气候条件下发挥作用,氧化NH4+并释放N2O。40°C以上,N2排放量迅速增加,这可能与土壤呼吸速率高导致O2有效性降低,厌氧微生物增多有关(图13b)。
![]() 图 13 土壤15N−N2O(a)与土壤排放气体N2O/N2(b)随温度变化(据Lai et al., 2019)Figure 13. Soil 15N−N2O (a) and soil emission of N2O/N2 (b) varies with temperature (after Lai et al., 2019)
图 13 土壤15N−N2O(a)与土壤排放气体N2O/N2(b)随温度变化(据Lai et al., 2019)Figure 13. Soil 15N−N2O (a) and soil emission of N2O/N2 (b) varies with temperature (after Lai et al., 2019)不同生态系统土壤N2O排放速率与排放量不同。其中农田和热带森林是土壤N2O人为和自然排放的两个主要途径(Tian et al., 2020)。农田土壤每年N2O排放约占全球人为活动N2O排放总量(6.7×106 t)的42%,尽管大气中N2O浓度呈增加趋势,然而N2O中15N的减少被认为是农田生态系统中氮肥施用量增加的结果(Park et al., 2012)。农田生态系统中氮肥的添加增加了氮的有效性,N2O生产过程有利于15N更大程度的分馏,使N2O中的15N耗竭,因此N2O中15N的差异有助于区分施肥土壤和其他土壤排放的N2O,Zhang et al.(2017)测定不同土壤类型产生的N2O的15N丰度值,得到的结果也证实了这一观点(图14)。
![]() 图 14 不同土壤类型产生N2O的15N丰度(据Zhang et al., 2017)Figure 14. Different soil types produce 15N abundance of N2O (after Zhang et al., 2017)
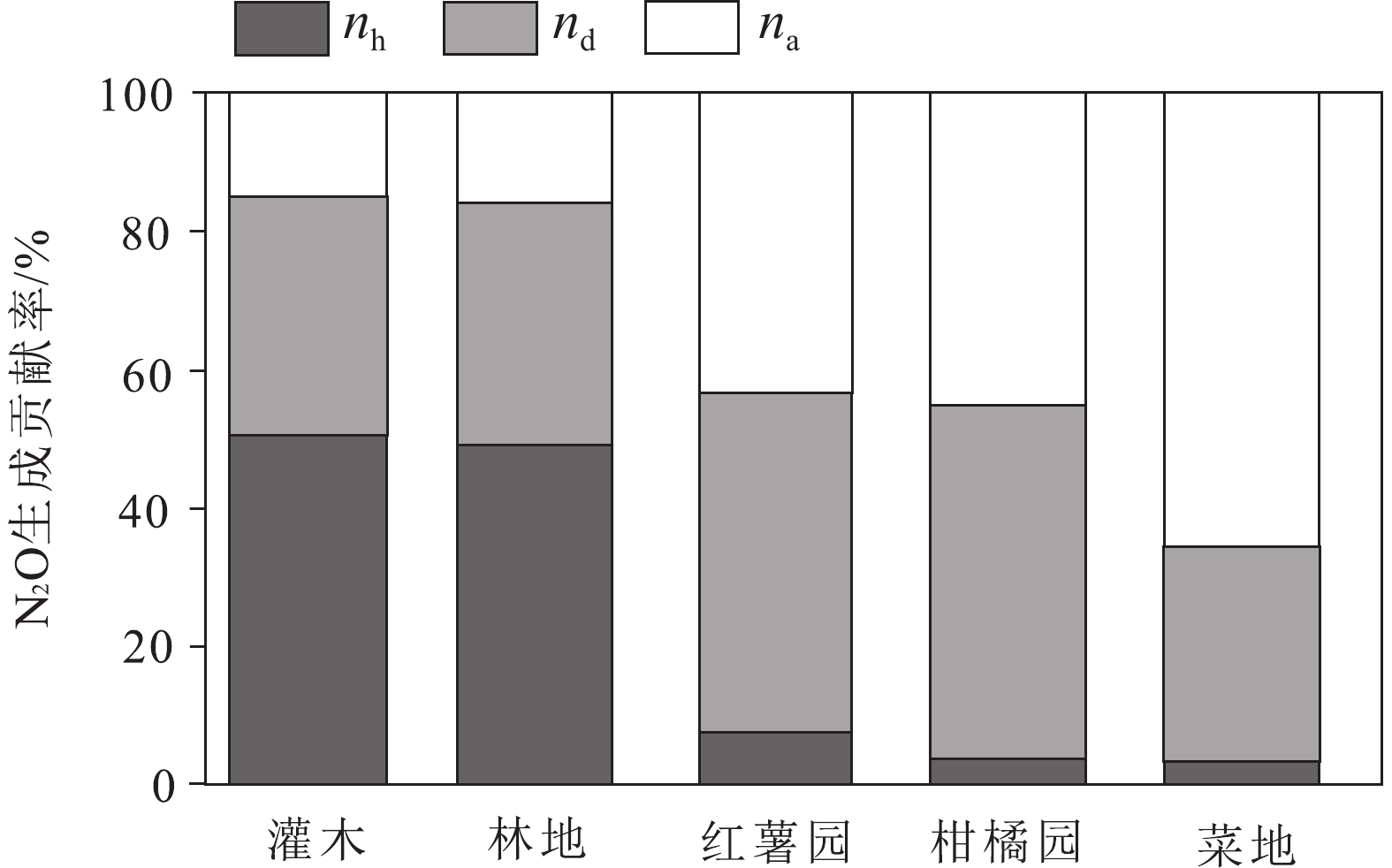
图 14 不同土壤类型产生N2O的15N丰度(据Zhang et al., 2017)Figure 14. Different soil types produce 15N abundance of N2O (after Zhang et al., 2017)农田土壤产生N2O的途径与其他土壤类型也具有显著差异。Zhang et al.(2018)利用15N标记技术量化不同土壤类型产生N2O的途径,结果发现,在自然土壤向农田土壤转化的过程中,N2O的主要产生途径由异养硝化作用转变为自养硝化作用(图15)。对于农田土壤,氮肥的施用会刺激氨氧化微生物的生长和活动,并增加自养硝化速率(Zhang et al., 2015a),而异养硝化作用的减弱则是由农田土壤相较于自然土壤的C/N比和有机碳含量降低导致的(Zhang et al., 2015a)。
![]() 图 15 不同土壤类型N2O产生途径nh、na和nd分别是异养硝化、自养硝化和反硝化对N2O生成的贡献(据Zhang et al., 2018)Figure 15. Pathway of N2O production in different soil types nh, na and nd are the contribution of heterotrophic nitrification, autotrophic nitrification and denitrification to N2O production, respectively (after Zhang et al., 2018)
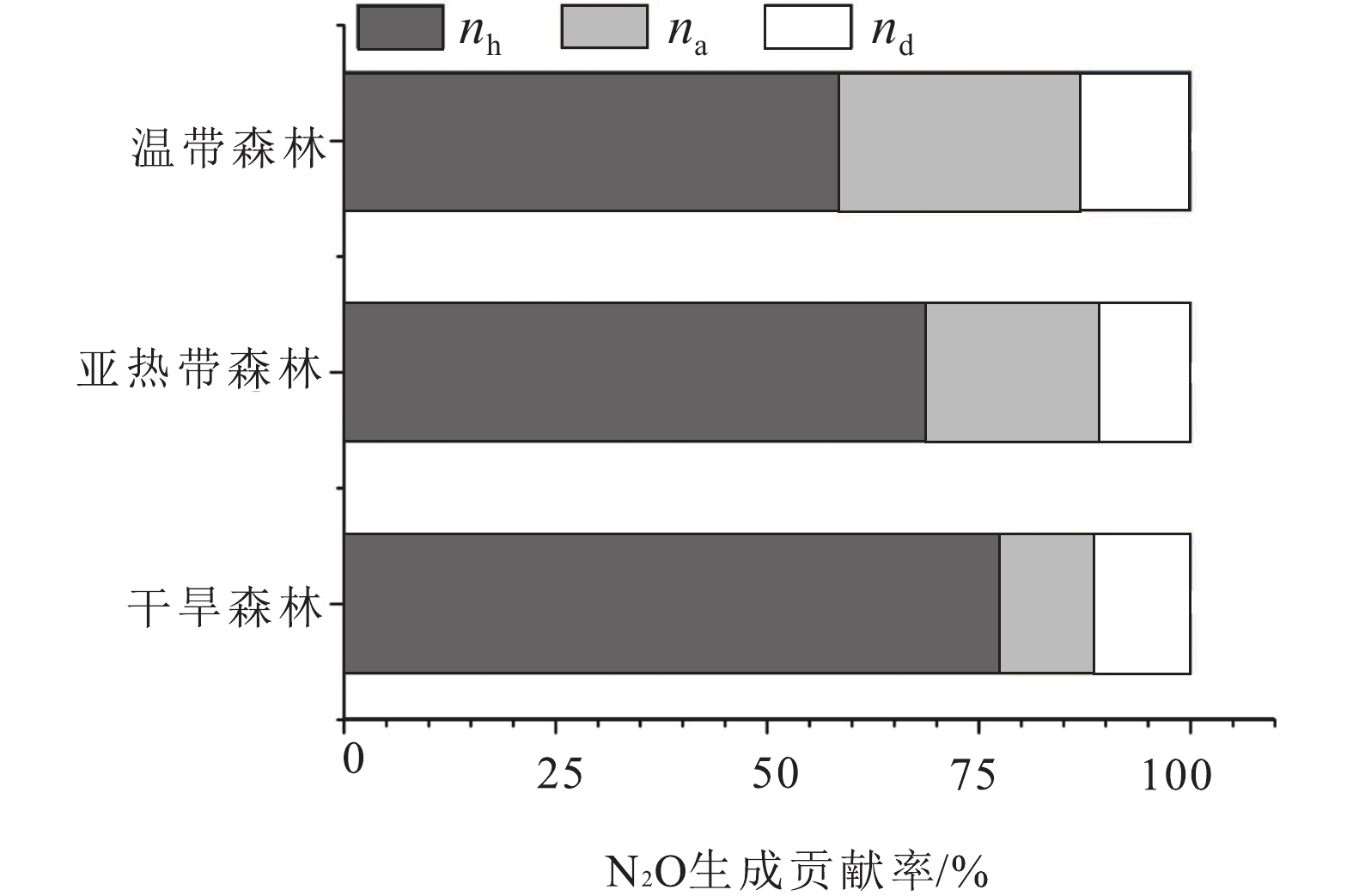
图 15 不同土壤类型N2O产生途径nh、na和nd分别是异养硝化、自养硝化和反硝化对N2O生成的贡献(据Zhang et al., 2018)Figure 15. Pathway of N2O production in different soil types nh, na and nd are the contribution of heterotrophic nitrification, autotrophic nitrification and denitrification to N2O production, respectively (after Zhang et al., 2018)森林土壤是全球陆地生态系统中N2O最大的来源(Tian et al., 2020)。以往的大量研究表明,森林土壤不同途径的N2O生产受土壤性质的调控,如土壤C/N、土壤有机碳和土壤pH值。高的C/N和有机碳使异养硝化细菌有充足的可利用碳源,低pH值也为异养硝化提供了有利条件(Cheng et al., 2019)。然而,对于温度和湿度对森林土壤产生N2O途径的影响目前还并不清晰,Pan et al.(2022)利用15N量化澳大利亚跨气候区森林N2O产生途径,发现随着气温的升高与降雨的减少,通过异养硝化作用产生的N2O排放量逐渐增大,通过自养硝化作用与反硝化作用产生的N2O排放量逐渐降低(图16)。
![]() 图 16 干旱、亚热带和温带气候带的澳大利亚森林土壤N2O产生途径nh、na和nd分别是异养硝化、自养硝化和反硝化对N2O生成的贡献(据Pan et al., 2022)Figure 16. N2O production pathways in Australian forest soils from arid, subtropical and temperate climatic zonesnh, na and nd are the contribution of heterotrophic nitrification, autotrophic nitrification and denitrification to N2O production, respectively (after Pan et al., 2022)
图 16 干旱、亚热带和温带气候带的澳大利亚森林土壤N2O产生途径nh、na和nd分别是异养硝化、自养硝化和反硝化对N2O生成的贡献(据Pan et al., 2022)Figure 16. N2O production pathways in Australian forest soils from arid, subtropical and temperate climatic zonesnh, na and nd are the contribution of heterotrophic nitrification, autotrophic nitrification and denitrification to N2O production, respectively (after Pan et al., 2022)目前不同生态系统N2O排放速率的计算与预测是基于大气氮沉降、氮肥与化石燃料燃烧的氮输入,并未考虑岩石风化释放的氮。然而,Wang et al.(2021)计算表明,全球陆地N2O输入通量中包括岩石风化作用具有重要贡献,其中有10%~20%是以前未被认识到的。
4.3 不同环境土壤δ15N
土壤的δ15N值主要受环境因子影响,不同环境下的土壤δ15N差异较大。全球范围内不同环境土壤统计特征值见表6。Craine et al.(2015)研究指出,高温干旱地区土壤δ15N值通常较高。在土壤含水量较高的地区,湿润的土壤环境有利于15N贫化的生物固氮过程,一定程度上抵消了土壤氮排放引起的15N富集,从而具有较低的土壤δ15N值(Aranibar et al., 2004)。温度升高可促进土壤反硝化作用与氨挥发过程,从而导致土壤氮的排放量增大,引起15N的富集(Craine et al., 2015;马秀艳等,2021)。从海拔高度来看,低海拔(<500 m)和高海拔(>3500 m)地区的土壤δ15N值相对较低,中低海拔(500~1000 m)至中高海拔(2000~3500 m)地区的土壤δ15N值相对较高(表6)。
表 6 全球范围内不同气候带和海拔范围内的土壤δ15N统计特征值(据昝麒麟等,2022)Table 6. Number of samples and statistical descriptions of soil δ15N on global scale in different climate zones and elevation ranges (after Zan Qilin et al., 2022)土壤环境 土壤δ15N值/‰ 气候带 赤道气候带 5.34 干旱气候带 5.78 暖温气候带 3.91 冷温气候带 3.98 极地气候带 3.98 海拔 <500 m 4.39 500~1000 m 4.70 1000~2000 m 4.72 2000~3500 m 4.78 >3500 m 4.18 土壤中复杂的氮转化过程导致δ15N值变化剧烈。通过NH3挥发、反硝化和不完全硝化产生的NO3−的淋滤或径流造成的氮损失,是土壤δ15N增大的关键氮循环过程。天然土壤δ15N值(−5‰~12‰)受温度和降水等因素的影响,最终影响氮循环的封闭性,导致与氮同位素分馏密切相关的氮损失。不同环境土壤δ15N值及其影响因素不同。农田土壤δ15N值(1‰~12‰)通常高于天然土壤,这是由于粪便或堆肥的施用(Park et al., 2023)。Escanhoela et al.(2019)研究表明由于常规施肥土壤的δ15N低于施用牲畜粪便的土壤(表7),因此施用富15N的牲畜粪便可使土壤的δ15N值增加。Jeong et al.(2022)研究表明,大量施用粪肥和堆肥的土壤比正常耕作土壤的δ15N增加了(9.6±1.5)‰。
表 7 不同种类肥料δ15N值(据Choi et al., 2017)Table 7. δ15N values of different kinds of fertilizers (after Choi et al., 2017)肥料种类 δ15N/‰ 平均δ15N/‰ 合成肥料 尿素 −5.9~1.9 −1.2 ± 0.4 硫酸铵 −3.9~6.6 −0.5 ± 0.7 硝酸铵 −1.7~2.6 0.1 ± 0.5 牲畜粪便 牛粪 3.5~16.5 8.4 ± 0.9 猪粪 4.4 ~11.3 6.7 ± 1.0 马粪 7.2~11.8 9.5 ± 2.3 家禽粪便 2.7~14.6 7.1 ± 1.5 对于草原,肥料对土壤δ15N的影响不如农田土壤显著,因为草原土壤中快速的氮循环改变了剩余氮的δ15N(Wells et al., 2015)。放牧也会对草原土壤δ15N值产生影响(Zhou et al., 2022)。在An and Li(2015)对荒漠草原进行为期7年的研究中,放牧对土壤的δ15N值没有影响;在高寒草原,Rui et al.(2011)发现放牧使土壤δ15N值增加了0.2‰。对于森林土壤,Choi et al.(2020)在对全球森林土壤δ15N的综述研究中指出,亚热带森林土壤δ15N值((3.0±2.1)‰)低于温带森林((0.3±3.0)‰)、热带森林((0.7±2.1)‰)和北方森林((−2.2±1.5)‰),这是由于亚热带森林的大气氮沉降高于其他森林。然而,目前对森林年龄、森林退化和包括灌溉及施肥在内的森林管理对δ15N的影响,由于数据变化范围大、不够丰富的原因还未得出一般性结论。
4.4 生物固氮
生物固氮是指大气中的游离态氮分子在微生物体内还原为结合态的氨分子过程,对全球生态系统氮素循环有着重要影响。从空气中固定的氮素占固氮植物全部氮素的比例称为固氮率。氮同位素自然丰度技术与氮同位素标记技术都是测定生物固氮率的常用方法,利用固氮植物和非固氮植物δ15N值的差异或测定植物样品的15N原子百分超和实验封闭系统中N2的15N原子百分超,以及固氮植物体内总氮量,即可计算得到植物生物固氮量(Liu et al., 2020)。生物固氮速率主要取决于土壤氮素有效性,土壤缺氮会抑制固氮酶的合成,高氮肥投入会降低生物固氮。钼是固氮酶的组成部分,Ma et al.(2019)利用15N标记法研究表明,在不施用氮肥的情况下,施用钼显著提高了水稻的固氮量,从22.3 kg/hm2增加到53.1 kg/hm2;Silva et al.(2017)利用15N贫化法确定施用钼肥有利于提高豆类籽粒固氮和籽粒重,并且孢粉的生物固氮更依赖于钼的施用。
除了一些可以从光合作用和化学自养中获得能量的非共生固氮微生物外,所有异养重氮生物都使用有机物质作为能源(Halm et al., 2012)。有研究发现,植物秸秆的施用刺激土壤生物固氮,与单独施用无机肥相比,有机物质与无机肥联合施用显著提高了土壤固氮效率(Liao et al., 2018)。Zhang et al.(2022)利用15N标记法添加不同生化成分差异的碳底物后测得稻田的生物固氮量比未添加时提高2.07倍;Xiu et al.(2021)利用15N自然丰度法确定生物炭通过增加根系活力、根尖数,促进大豆根系养分的获取。根系生长策略的改变促进了与大豆共生的根瘤菌生物固氮,从而提高了作物产量。
Ladha et al.(2016)计算出作物生产过程中使用的氮素50%被作物(玉米,水稻和小麦)吸收,其中约52%不能被植物利用,流失到土地和水中,或通过反硝化作用还原为N2O。这导致了土壤压实、酸化、重金属离子释放、微生物群失衡、温室气体排放增加等严重的环境问题,威胁到农业的可持续发展和作物安全。因此,提高作物生物固氮的能力将有助于解决这些问题。由于生物固氮是一个涉及寄主植物和固氮菌的过程(图17),因此目前许多研究除了着眼于提高植物氮的可用性,更将研究重点放在提高微生物的固氮能力上(表8)。
![]() 图 17 作物生物固氮过程(据Guo et al., 2023)Figure 17. Biological nitrogen fixation in crops (after Guo et al., 2023)表 8 利用氮同位素技术提高作物相关微生物固氮的研究现状Table 8. Research status of nitrogen isotope technology to improve nitrogen fixation by crop−related microorganisms
图 17 作物生物固氮过程(据Guo et al., 2023)Figure 17. Biological nitrogen fixation in crops (after Guo et al., 2023)表 8 利用氮同位素技术提高作物相关微生物固氮的研究现状Table 8. Research status of nitrogen isotope technology to improve nitrogen fixation by crop−related microorganisms作物种类 研究现状 参考文献 水稻 利用15N直接标记测定稻田固氮量,发现水稻种植极大地促进了固氮菌nifH基因的表达,提高了固氮菌的固氮活性,增加了稻田各层土壤的固氮量 张燕辉等(2021) 玉米 利用15N自然丰度法进行实验证明,墨西哥玉米品种ierra Mixe根部产生的黏液中具有活性nif基因的细菌菌株,可以满足该玉米品种氮需求的29%~82% Van Deynze et al. (2018) 将氮肥替换为30% atom15N标记的(NH4)2SO4,测定γ−变形杆菌通过生物固氮贡献了玉米茎中积累的11.8%的总氮 Zhang et al. (2022) 甘蔗 利用15N自然丰度法确定接种重氮营养菌使RB92579和RB2003两种甘蔗品种的生物固氮量分别增加了50和17 kg/hm2 Martins et al. (2020) 通过对植株组织、植株产物和叶绿素的15N同位素稀释,证实了克莱伯菌与甘蔗共生,能缓解氮素缺乏症的发生 Luo et al. (2015a) 豆类 利用15N贫化法确定接种根瘤菌有利于提高籽粒固氮和籽粒重。与Apore品种相比,Ouro Negro品种的根瘤数量和重量以及从大气中获得的氮量更高 Silva et al. (2017) 除了应用于提高生物固氮率研究,氮同位素技术还可以在农业间作生产中发挥作用。豆科作物与根瘤菌形成根瘤固定大气氮,从而减少氮肥施用,因此豆科作物与禾本科植物间作被认为是农业可持续发展的重要模式之一。15N示踪技术可以研究豆科作物转移到间作作物氮素的比例,从而为氮素的合理利用、在减少氮肥施用量情况下增加作物产量提供依据。例如,冯晓敏等(2023)利用15N标记技术,发现间作绿豆向燕麦的氮素转移率2年平均值达31.7%,氮素转移量为212.16 kg/hm2;Chapagain and Riseman(2014)研究发现,在大麦−豌豆间生产统中,豌豆体内的氮素有11%转移到大麦植株;Hauggaard−Nielsen et al.(2009)利用15N自然丰度法研究,发现大麦−豌豆间作生产中,豌豆固氮效率为55.1%~66.7%,大麦氮素积累量的1.9%~11.1%来源于豌豆生物固氮。
4.5 生态系统氮状态
氮的有效性是一个相对性的概念, 是指相对于植物和微生物氮需求的土壤氮供给(McLauchlan et al., 2010)。δ15N的变化能够反映不同生态系统氮有效性的差异和历史变化。当土壤氮供给大于生物需求时, 更多14N通过淋溶或是气态氮释放而损失, 而更多的15N留在植物组织或土壤里, 造成植物和土壤呈现较高的δ15N。因此, 氮供应的增加导致氮的有效性增加,植物体内δ15N值通常就越高(Mason et al., 2022)。
植物叶片和树木年轮的δ15N值已被用作研究氮循环对大气氮沉降响应的有力指标。与北方和温带森林等氮限制森林相比,在大气氮沉降强烈的气候中,如亚热带和热带森林,由于温暖条件下的快速氮矿化,氮有效性很高(表9)。
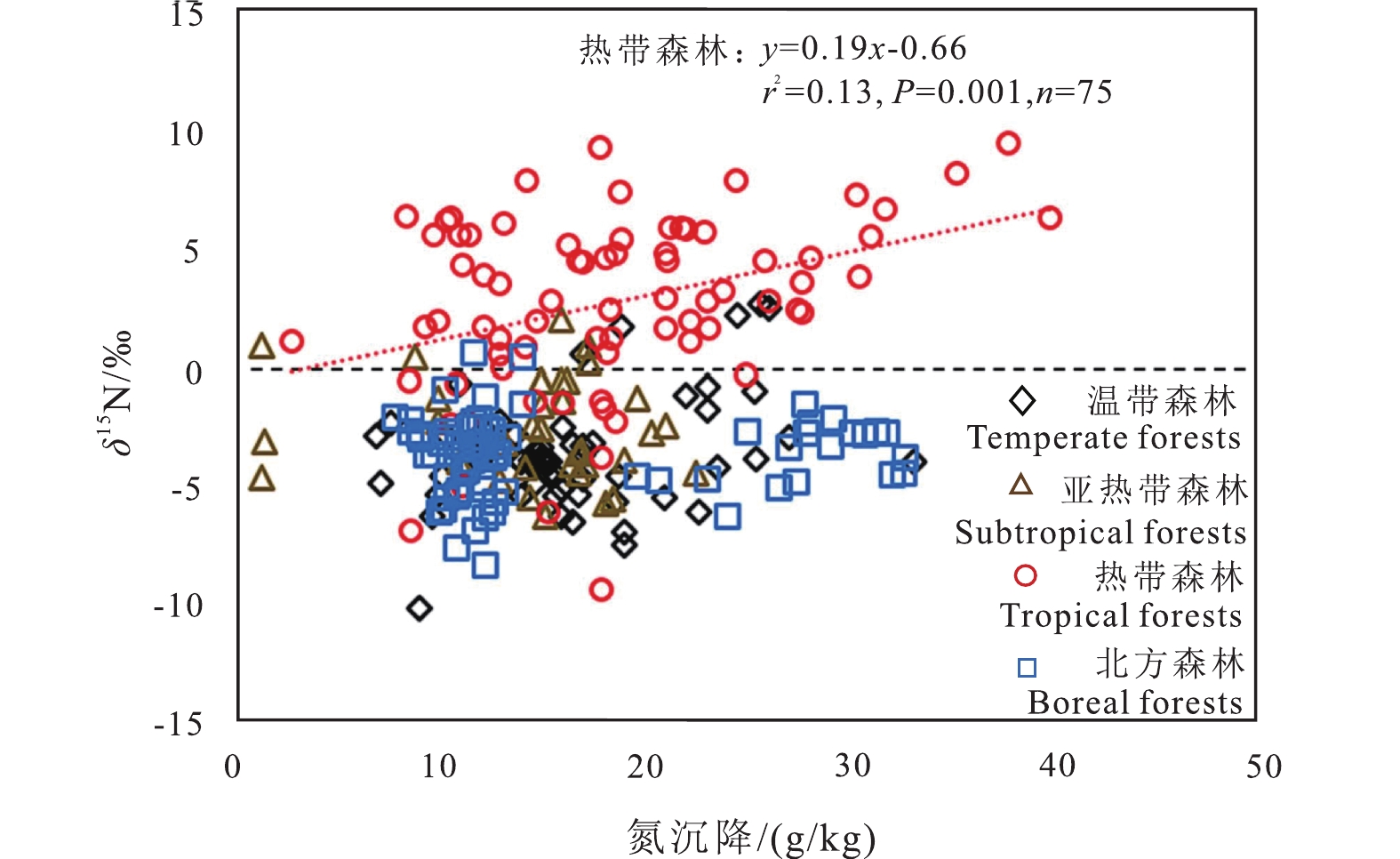
表 9 不同大陆和气候带森林的大气氮沉降速率(据Schwede et al., 2018)Table 9. Atmospheric N deposition rates for forests in different continents and climate zones (after Schwede et al., 2018)气候带 地区 氮沉降速率/(kg/hm2/a) 亚洲 7.8 温带 美洲 5.4 欧洲 10.8 亚洲 29.3 北美洲 7.2 亚热带 南美洲 10.5 欧洲 10.5 非洲 7.9 热带 亚洲 11.8 北美洲 7.4 南美洲 5.8 欧洲 7.1 Liu et al.(2013)对来自中国各地的样本研究发现,自20世纪80年代以来,叶片δ15N随着大气氮沉降的增加而增加;Choi et al.(2023)收集了全球范围内244个不同地区的氮沉降和叶片δ15N数据,证实了热带地区大气氮沉降与叶片δ15N之间的正相关关系(图18);Craine et al.(2018)进一步整合了全球近37年来43000多个植物叶片样品的δ15N和氮含量数据,发现近30年叶片δ15N和氮含量均出现下降趋势,指出陆地生态系统生产力可能越来越受氮限制。不同气候带叶片δ15N也存在差异(表10),热带地区植物叶片δ15N显著高于其他气候带,大气氮沉降与叶片δ15N之间的正相关,说明热带地区叶片较高的δ15N是高氮有效性驱动的。然而,在温带和亚热带森林中,氮沉降量较高,叶片δ15N低可能反映了大气氮对植物氮营养的重大贡献(Lin et al., 2020)。
![]() 图 18 氮沉降与不同地区森林叶片δ15N的相关性(据Choi et al., 2023)Figure 18. Correlation between nitrogen deposition and δ15N of forest leaves in different regions (after Choi et al., 2023)表 10 不同地区植物叶片的δ15N和氮含量(据Choi et al., 2023)Table 10. δ15N and N concentration of foliage in different zones (after Choi et al., 2023)
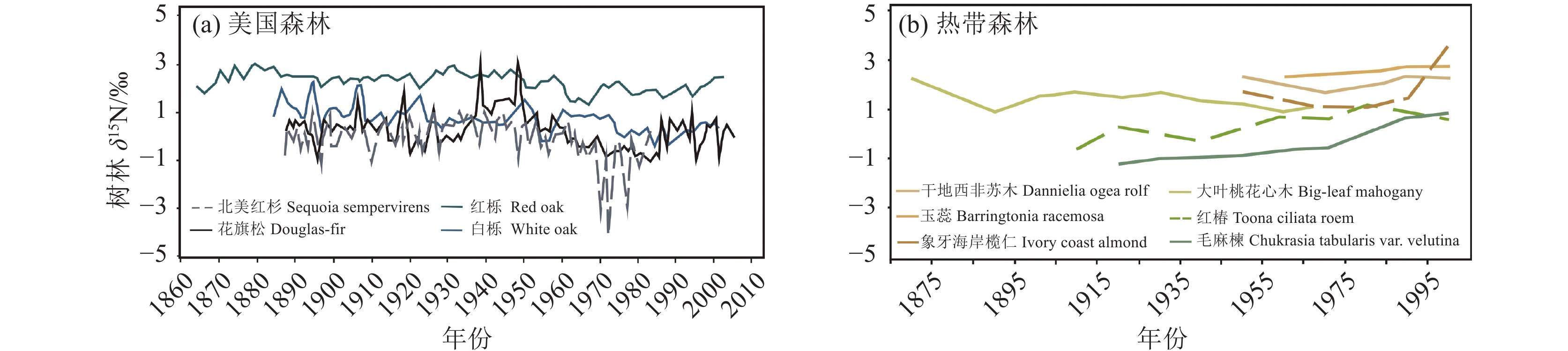
图 18 氮沉降与不同地区森林叶片δ15N的相关性(据Choi et al., 2023)Figure 18. Correlation between nitrogen deposition and δ15N of forest leaves in different regions (after Choi et al., 2023)表 10 不同地区植物叶片的δ15N和氮含量(据Choi et al., 2023)Table 10. δ15N and N concentration of foliage in different zones (after Choi et al., 2023)气候带 叶片δ15N/‰ 叶片氮含量/(g/kg) 温带 −2.4±2.2 16.4±5.2 亚热带 −2.5±2.0 14.6±5.0 热带 1.6±4.3 18.5±7.3 保存在树轮中的氮化合物能提供十年到千年时间尺度上的植物氮吸收利用信号,成为陆地生态系统氮循环特征的可靠综合度量指标(Gerhart and McLauchlan, 2014)。McLauchlan et al.(2010)利用树木年轮δ15N指出美国温带森林氮的有效性在近150多年呈逐渐下降的趋势(图19a)。还有研究认为,气候变化或升高的大气CO2浓度会通过影响菌根活动和改变土壤氮循环等,使得温带森林树轮δ15N值下降。热带森林的绝大多数树轮δ15N呈现为上升趋势(图19b),表明热带地区相对其他研究区域,氮循环系统更为开放。虽然树轮δ15N的普遍下降反映了氮有效性的长期下降(Mason et al., 2022),但也可能反映了在受重工业化影响的地区15N耗竭的氮沉降对树木氮营养的影响。例如,韩国温带森林由于20世纪70年代以来的重度工业化,高大气氮沉降下树轮δ15N急剧下降了4‰(Choi et al., 2005;Kwak et al., 2011)。
![]() 图 19 北美森林(a)与热带森林(b)不同树种树轮δ15N变化趋势比较(据王可逸等,2021)Figure 19. Comparison in the regional trends of global tree-ring δ15N in North American forests (a) and tropical forests(b) (after Wang Keyi et al., 2021)
图 19 北美森林(a)与热带森林(b)不同树种树轮δ15N变化趋势比较(据王可逸等,2021)Figure 19. Comparison in the regional trends of global tree-ring δ15N in North American forests (a) and tropical forests(b) (after Wang Keyi et al., 2021)4.6 植物吸收氮偏好
氮是决定陆地生态系统生产力的关键因子(Du et al., 2020)。植物对不同形态氮的吸收偏好直接影响输入到自然生态系统中氮的去向和氮动态的变化, 对预测植物对未来环境变化的响应、植物种子库的利用与再造林工作具有重要意义(Jiang et al., 2015)。一般情况下,大气中的N2通常不能被植物直接吸收。只有一些固氮植物,特别是豆科植物和一些藻类、菌类可以直接转化大气中的N2而吸收氮。其他植物必须从其他氮源中吸收NO3-和NH4+来获取维持正常生理功能所需要的氮,最后形成植物有机质。
目前氮同位素技术越来越多地被应用于分析植物氮利用特点和偏好,以推测植物的氮适应机制。若考虑植物吸收NH4+、NO3−和溶解有机氮(DON),则需要测定植物以及土壤NH4+、NO3−和溶解有机氮(DON)的δ15N,通过计算即可得出植物对不同形态氮的吸收情况。研究表明,在恶劣环境中,如常年低温、氮矿化受到强烈限制的地区,植物根系可以吸收有机氮化合物(Miller et al., 2007;Wang and Macko, 2011)。在受到污染的环境中,植物可以通过叶片吸收大气中的氮(Chalk and Smith, 2021)。不同环境中土壤的有效氮形态不同,植物吸收氮偏好与土壤有效氮存在形式直接相关。在肥沃的碱性土壤中,植物主要吸收NO3−;在热带、亚热带地区,有机氮矿化为NH4+的速率较高,而NH4+氧化为NO3-的速率降低,并且大量的降雨使土壤流失NO3−,导致NH4+成为土壤和植物吸收的主要氮形态(Cheng et al., 2014;Zhang et al., 2016b)。
植物与土壤的相互作用,包括根系分泌物和凋落物,也可以影响土壤氮素转化(Nardi et al., 2013)。例如在森林和农田土壤中,树木根系或叶中分泌的有机化合物的过程如单宁和单宁衍生物,可以抑制NH4+氧化成为含NO3−的酚类化合物。一些树种,如针叶栎和松树,这些树种的根分泌物,特别是热带植物,被认为影响控制了土壤中的硝化作用(Byrnes et al., 2017)。除了化学物质的释放外,C/N比大的植物凋落物的输入也会由于NH4+的固定刺激而间接抑制硝化作用(Wang et al., 2015)。因此,在稳定的生态系统当中,外来植物的入侵对土壤氮转化的影响是改变原生植物对土壤氮素吸利用偏好的一个重要因素(表11)。
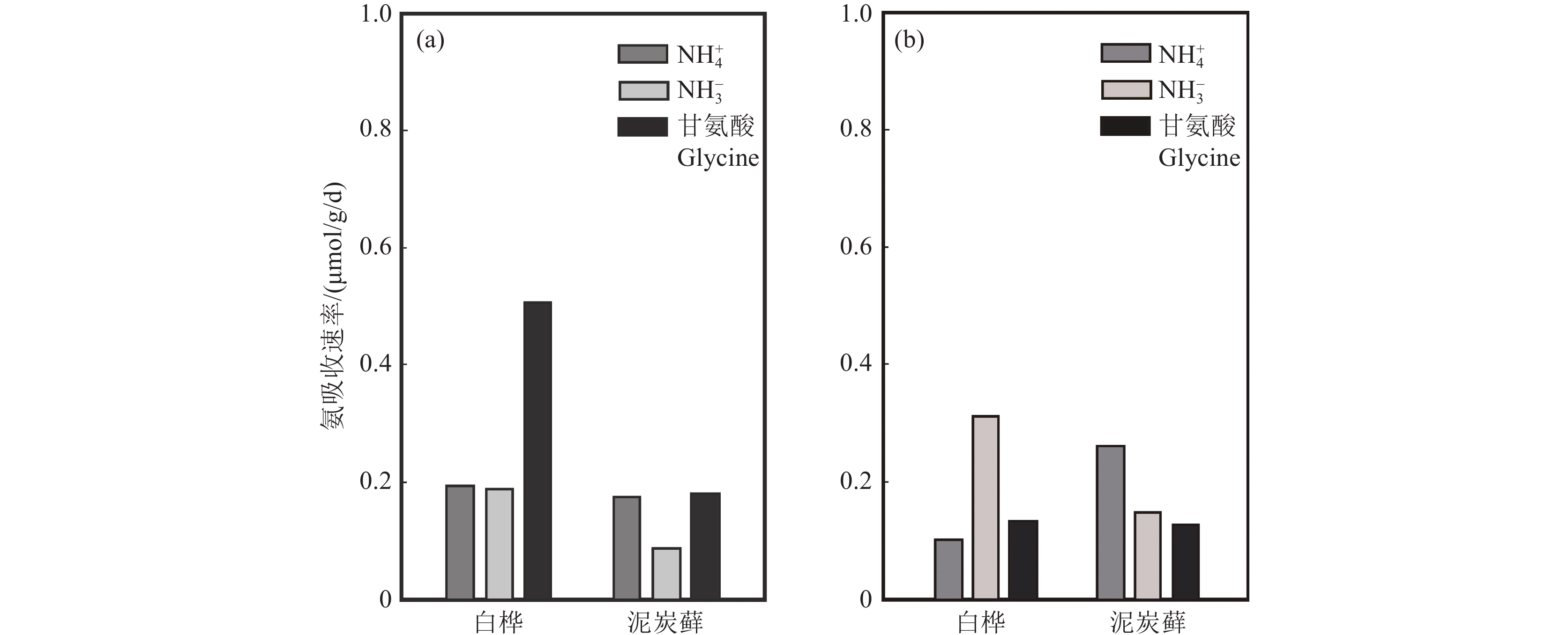
表 11 入侵物种对土壤有效氮的影响Table 11. Effects of invasive species on soil available nitrogen地区 入侵物种 对土壤有效氮影响 参考文献 北美 矢车菊 根系分泌儿茶素显著抑制土壤硝化速率,导致入侵地土壤NO3−浓度降低 Thorpe and Callaway,2011 北美 虎杖 分泌单宁抑制土壤的氮矿化作用,导致土壤无机氮浓度较低,总游离氨基酸和可溶性有机氮的浓度升高 Tharayil et al.,2013 中国北方 火炬树 提高土壤的硝化速率,土壤NO3−含量升高,土壤NH4+含量降低 黄乔乔等,2013 海南 金钟藤 土壤NO3−、NH4+含量升高 纵熠等,2015 澳大利亚 须芒草 提高土壤氨化作用,抑制土壤氮硝化,土壤NH4+含量增加 Rossiter−Rachor et al.,2009 对于不同生态环境下的同一物种,Gao et al.(2020)利用15N自然丰度法,对温带森林和冷温带森林植被对氮形态吸收偏好进行了研究,结果表明,冷温带地区白桦根系δ15N的自然丰度显著高于温带地区,而温带地区泥炭藓根系δ15N的自然丰度显著高于冷温带地区。温带地区的白桦更容易吸收甘氨酸衍生的氮,而在冷温带地区,白桦更偏好吸收NO3−衍生氮;相较于温带地区泥炭藓在冷温带地区偏好吸收NH4+衍生氮(图20)。北方森林、温带森林和亚热带人工林树种偏好利用土壤中铵态氮,这些研究中植物吸收的优势氮形态与土壤中优势氮形态一致(Nordin et al., 2001;Zhou et al., 2019;Liu et al., 2020)。
![]() 图 20 温带地区(a)和冷温带白桦和泥炭藓(b)吸收氮偏好(据Gao et al., 2020)Figure 20. Preference for nitrogen uptake by birch and sphagnum moss in temperate zones (a) and cold temperate zones(b) (after Gao et al., 2020)
图 20 温带地区(a)和冷温带白桦和泥炭藓(b)吸收氮偏好(据Gao et al., 2020)Figure 20. Preference for nitrogen uptake by birch and sphagnum moss in temperate zones (a) and cold temperate zones(b) (after Gao et al., 2020)利用氮同位素技术研究植物吸收氮偏好,可以反映在植物和土壤微生物氮竞争条件下的氮吸收偏好。然而田间或室内培养实验施用15N示踪剂的植物吸收氮能力受微生物影响较大,因此难以精准地确定植物氮源分配策略。除此之外,植物吸收氮的部位不一定与最终同化氮的部位相同,因为在最终氮同化之前,被吸收的氮可以在叶片和根之间进一步重新分配,但目前还未开发新的方法确定植物叶片和根系之间土壤NH4+和NO3−源的分配和同化。
4.7 植物地理溯源
与动物不同,植物固定生长,体内的稳定同位素组成与它的生长环境息息相关,植物体内的稳定同位素组成在一定程度上可以反映其生长环境情况。地质背景、海拔、气候和降水造成了同位素比值的自然地理差异,但这些差异在特定区域内是一致的(Taous et al., 2020),因此可以将稳定同位素作为地理来源的示踪剂。例如,Oulimata et al.(2022)发现不同地理来源的金合欢叶片的δ15N值随生长环境变化,来自干旱地区的金合欢叶片小叶宽度与δ15N值呈正相关,与叶片耳廓数呈负相关,而来自其他地区的金合欢叶片叶柄长度与δ15N值呈正相关。近年来,稳定同位素技术更多地应用于农产品产地溯源,Luo et al.(2015b)分别测定了来自美国、加拿大、澳大利亚和中国等不同产地小麦样品的稳定氮同位素组成,发现不同来源的不同种类小麦的δ15N的平均值存在显著差异,可以鉴别小麦的产地(表12)。
表 12 不同地区小麦样品δ15N值(据Luo et al., 2015b)Table 12. δ15N values of wheat samples from different regions (after Luo et al., 2015b)来源 δ15N/‰ 美国 3.04±0.79 加拿大 2.13±0.70 澳大利亚 7.25±1.18 中国 2.45±0.5 然而仅通过检测分析单一稳定同位素或矿物质元素进行溯源会使结果出现较大偏差,成功率较低。产地溯源时所参考的指标均存在一定优缺点,例如 δ13C可以综合反映温度等环境因子,但其在距离相近的地区之间差异不显著,无法有效判别;δ15N是土壤氮来源、土地利用方式、耕作措施等的良好指示,但其同一个地区不同样品间变异较大(王黎明等,2015),因此通常将稳定碳、氮同位素结合起来进行产地溯源,提高溯源结果的准确率。例如Wu et al.(2015)测定了中国黑龙江省、山东省和江苏省这三个省份五种谷物的δ13C和δ15N值(表13),可以看出不同地区的谷物δ15N差异不显著,但结合δ13C,可以有效判别谷物的地理来源;Suzuki(2021)统计了来自不同国家和地区的水稻δ13C和δ15N值,结果发现,美国加利福尼亚与日本长野县的水稻δ15N均为2.8‰,而δ13C值具有明显差异,分别为−25.6‰和−26.9‰,表明碳、氮同位素结合可以精准反映植物的地理来源。
表 13 不同地区谷物δ15N与δ13C值(据Wu et al., 2015)Table 13. δ15N and δ13Cvalues of different cereal grains from different origins (after Wu et al., 2015)谷物 平均δ15N/‰ 平均δ13C/‰ 黑龙江 山东 江苏 黑龙江 山东 江苏 水稻 3.070 3.434 3.221 −26.285 −26.946 −27.578 大豆 1.365 1.462 1.388 −23.679 −25.642 −26.102 小米 1.098 1.251 1.112 −11.985 −12.346 −12.897 小麦 1.827 1.934 1.850 −22.843 −25.694 −25.162 玉米 0.237 0.432 0.292 −10.965 −10.444 −11.292 5. 氮同位素技术识别地表水、地下水和大气氮污染源
5.1 地表水和地下水的氮源识别
地表水与地下水氮污染来源多样,主要有降水、土壤氮矿化、未被作物吸收的氮肥、粪肥中尿素水解、生活和工业废水中的氨氮和有机氮化合物经过硝化生成的硝酸盐等 (Zendehbad et al., 2019)。
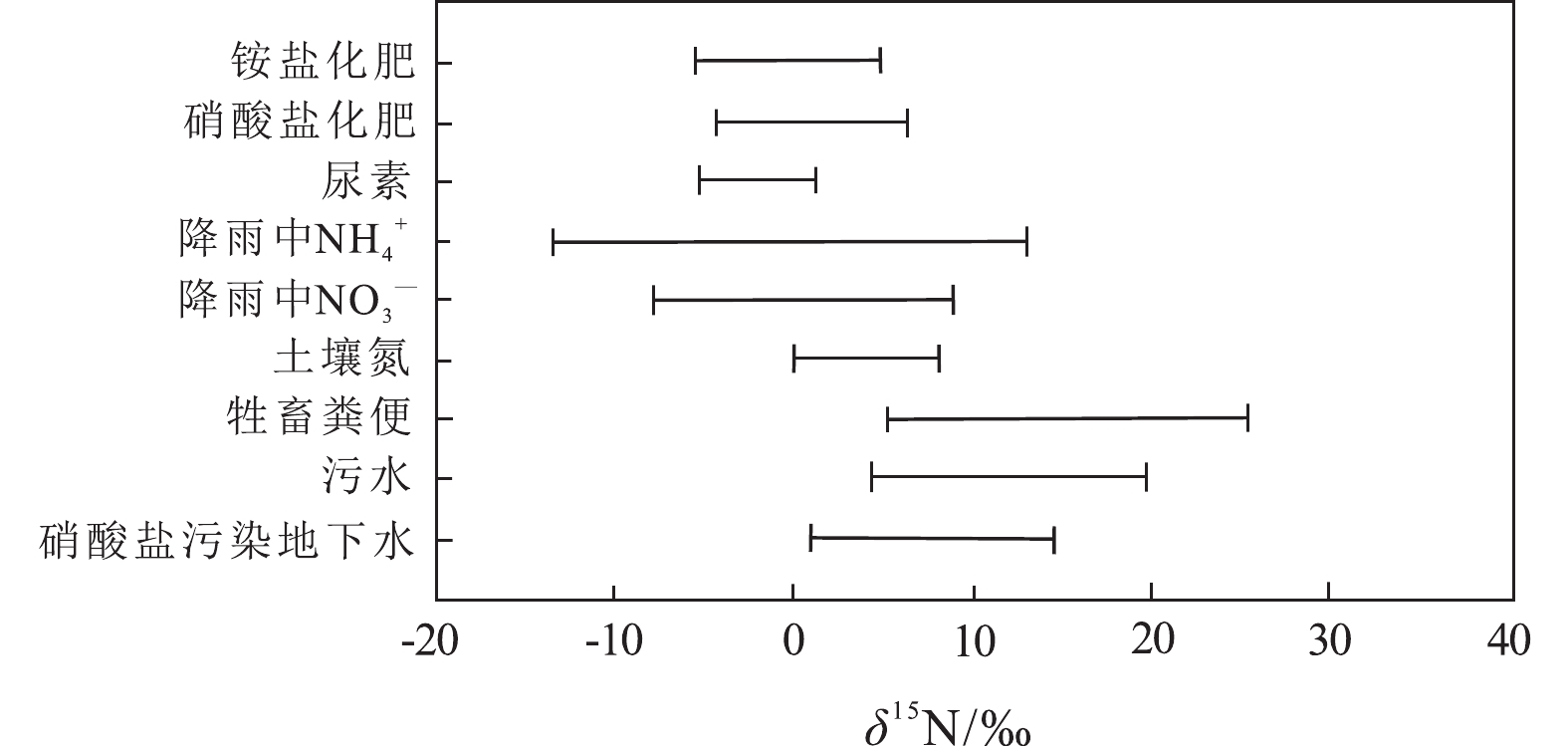
不同形态氮在进入地表水或地下水的过程中,氮同位素经历不同程度的分馏过程,导致不同污染来源水体氮的δ15N值有不同的分布范围,通过测定水体的δ15NO3−、δ15NH4+值,确定其取值所处区间,利用同位素混合模型可以推断其污染来源(Xue et al., 2009)。然而不同污染源的δ15N分布区间有所重叠(图21),且存在地区和时间差异性,例如中国降水δ15N值的变化范围为3‰~7‰,而其他国家和地区为6‰~11‰(Zhang et al., 2019)。因此,仅靠氮同位素技术可能不足以识别氮污染源和了解氮的迁移和转化途径。
![]() 图 21 不同污染来源δ15N值分布(据Xue et al., 2009)Figure 21. Typical ranges of δ15N values from different pollution sources (after Xue et al., 2009)
图 21 不同污染来源δ15N值分布(据Xue et al., 2009)Figure 21. Typical ranges of δ15N values from different pollution sources (after Xue et al., 2009)5.1.1 硝酸盐的氮氧同位素源识别
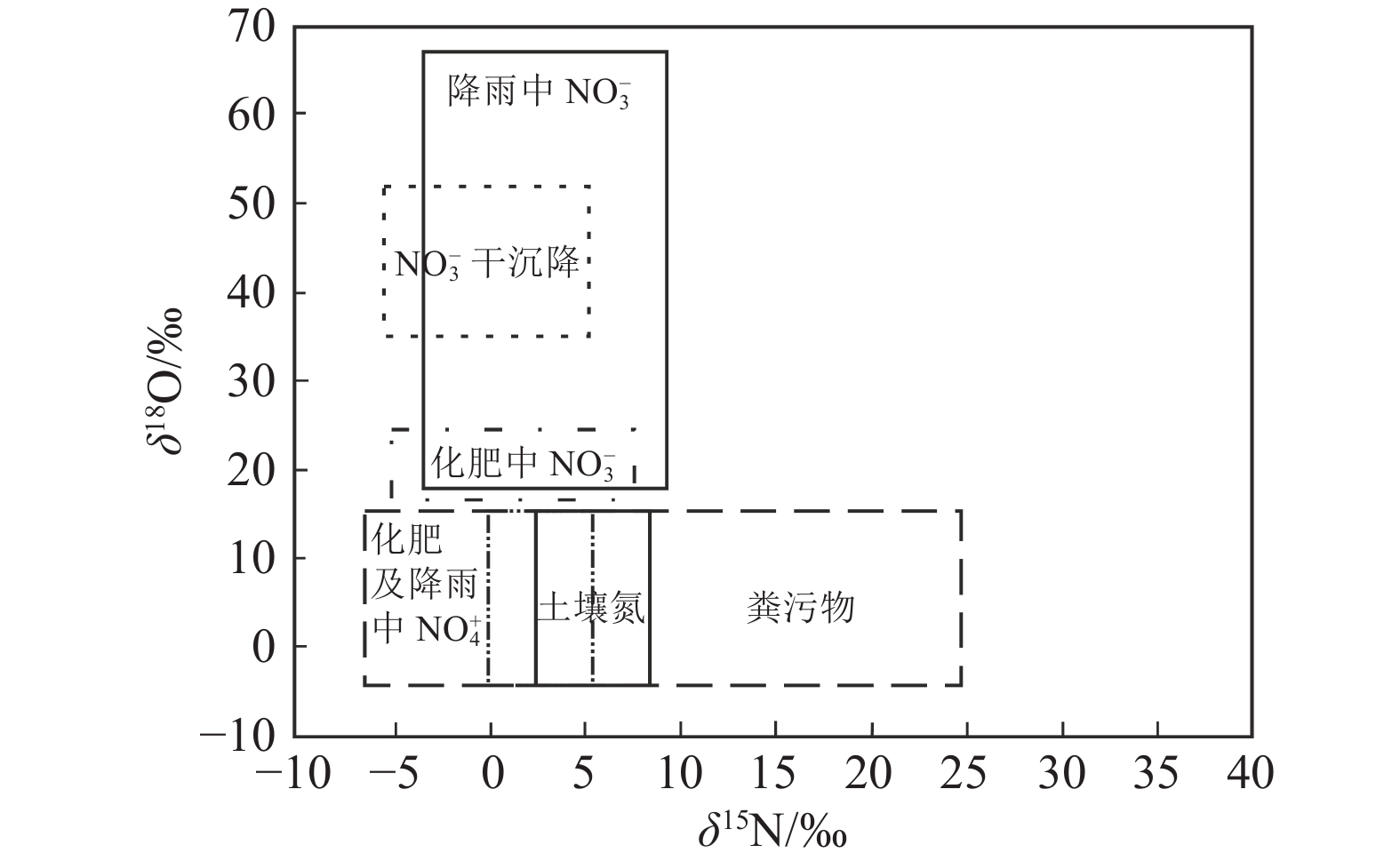
Kendall et al. (2007)总结了不同来源硝酸盐δ15N和δ18O的分布区间(图22),并提出了使用氮、氧双同位素识别硝酸盐污染源的方法。近几年,结合δ15N−NO3−和δ18O−NO3−分析的双稳定同位素分析技术被广泛用于追踪地下水硝酸盐的来源(Ahmed et al., 2012),该方法能够克服单一同位素的局限性,改善了单一氮同位素特征值取值区间重叠的问题,拓宽了识别范围。硝酸盐污染的主要来源一般取决于土地利用类型、流域的地理位置与气候条件。
![]() 图 22 不同污染来源δ15N与δ18O值分布(据Kendall, 1998)Figure 22. Typical ranges of δ15N and δ18O values from different pollution sources (after Kendall, 1998)
图 22 不同污染来源δ15N与δ18O值分布(据Kendall, 1998)Figure 22. Typical ranges of δ15N and δ18O values from different pollution sources (after Kendall, 1998)化肥、降水、土壤氮和生物固氮是河流硝酸盐的主要来源。农田作物的施肥方式和土壤微生物的活性等因素对农田区地表水和地下水中硝酸盐的来源鉴定有很大影响。Kellman(2005)发现施用动物粪便的农田废水中δ15N值远高于施用无机肥的农田废水中δ15N值。硝酸盐从土壤向河流迁移时,微生物等影响因素导致15N富集,因此微生物活性高时硝酸盐污染源的同位素特征不明显。然而,当微生物的活性较低时,在硝酸盐迁移过程中,δ15N和δ18O值相对稳定,能够准确识别硝酸盐来源(Zhang et al., 2014)。Deutsch et al.(2006)研究表明冬季农田废水的δ15N和δ18O值显著高于地下水和降水,河流和农田污水的δ15N和δ18O值相近。利用氮氧双同位素技术的研究结果表明,农田废水和河流中硝酸盐的高浓度与大量化肥的施用直接相关(Ding et al., 2014)。
对于以混合用地为主的流域,地表水和地下水硝酸盐主要来源于生活污水、工业污水的排放。季节变化和人类活动是影响硝酸盐来源的主要因素。在雨季,大气降水对硝酸盐来源的贡献率可达50%~67%(Zhang et al., 2019)。Chen et al.(2012)通过测量δ15N和δ18O值对太湖地区硝酸盐来源的研究表明,夏季硝酸盐主要来源于降水、生活污水和有机肥,冬季硝酸盐主要来源于生活污水、有机肥和土壤有机氮的硝化作用。基于δ15N和δ18O联合示踪技术,Archana et al.(2018)发现污水是地表水的主要硝酸盐源,硝化和固氮作用是主要驱动因素。
5.1.2 氮同位素结合其他元素同位素进行氮源识别
河流中溶解无机碳同位素δ13C的变化反映了碳的地球化学行为和生物地球化学循环。由于污染物的多种来源和反应机理会引起同位素信号的叠加,因此可以通过δ15N、δ18O和δ13C来追踪硝酸盐来源及其转化方式。Li et al.(2014)利用δ15N、δ18O和δ13C来确定潮白河上游硝酸盐的来源和转化途径,发现雨季土壤氮是硝酸盐的主要来源,旱季则以污水和粪便为主要来源。
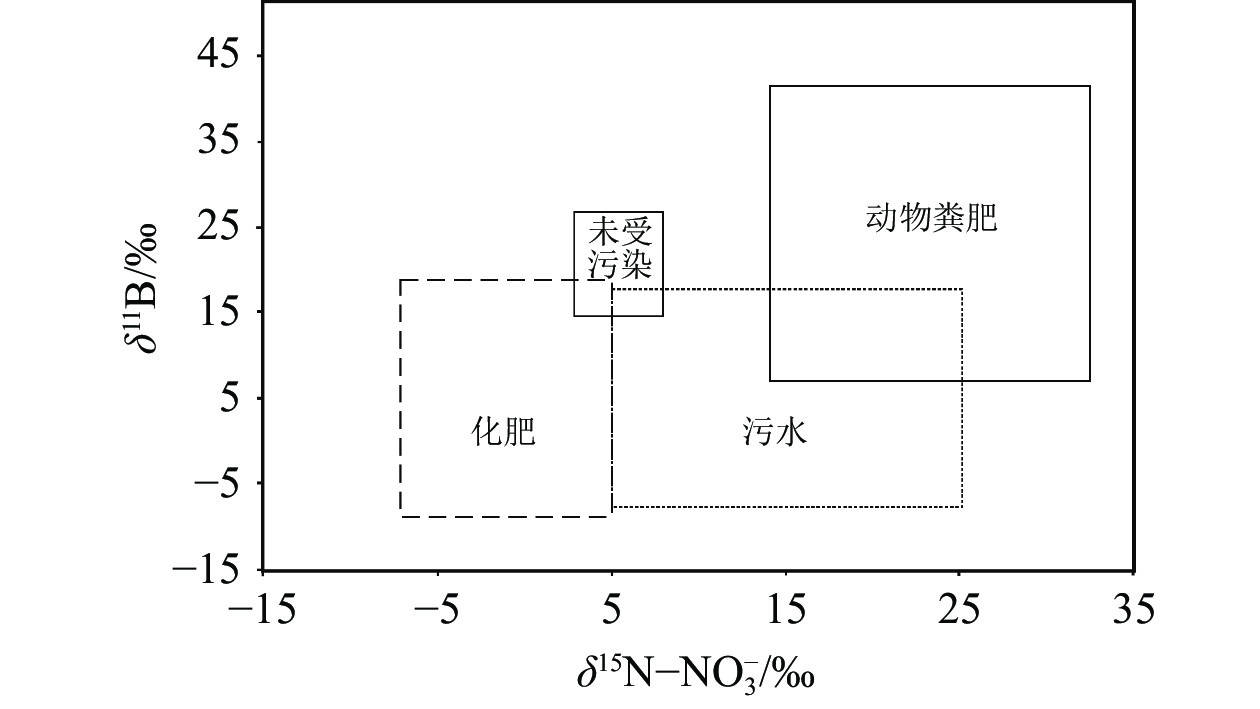
除了δ15N、δ18O和δ13C同位素示踪外,部分学者采用了氮同位素与硼同位素相结合识别氮源。在大多数硝酸盐污染源中,硼也存在显著富集,不同来源硼的同位素组成差异明显,且硼同位素组成不受氮转化过程的影响,在区分动物排泄物方面作用明显(Briand et al., 2017)。Widory et al.(2013)研究表明,生活污水的δ11B为−7.7‰~12.9‰,动物粪肥的δ11B为6.9‰~42.1‰,化肥的δ11B为8‰~17‰。结合δ11B与δ15N,在很大程度上可区分动物粪肥、化肥和污水来源的硝酸盐污染(图23)(Briand et al., 2013)。
![]() 图 23 典型污染来源δ15N与δ11B值分布(据Sankoh et al., 2022)Figure 23. Typical δ15N and δ11B values from different pollution sources (after Sankoh et al., 2022)
图 23 典型污染来源δ15N与δ11B值分布(据Sankoh et al., 2022)Figure 23. Typical δ15N and δ11B values from different pollution sources (after Sankoh et al., 2022)5.1.3 数学模型在硝酸盐氮氧同位素源识别中的应用
Phillips and Koch(2002)发展了一种基于两种同位素和三种来源的混合模型:
δ15N=f1×δ15N1+f2×δ15N2+f3×δ15N3 (6) δ18O=f1×δ18O1+f2×δ18O2+f3×δ18O3 (7) f1+f2+f3=1 (8) 式中,式中,δ15N1、δ15N2、δ15N3和δ18O1、δ18O2、δ18O3是混合物中3种不同来源δ15N、δ18O值;f1、f2、f3是3种不同污染源的贡献率。同位素混合模型没有考虑污染源的不确定性,如污染源的时空差异性,以及氮迁移转化过程中的同位素分馏效应等,也无法定量分析污染源超过3种的情况(Yang et al., 2013)。
在同位素混合模型的基础上,Parnell et al.(2010)基于R语言软件首次开发了SIAR(Stable Isotope Analysis in R)模型,同位素数据与贝叶斯混合模型的耦合为估计不同NO3−源的贡献提供了强有力的工具。SIAR模型运行需要输入样品和源谱的δ15N信息,样品的δ15N信息是一个固定的数值, 源谱信息包括某类污染来源的δ15N特征值及标准差,基于贝叶斯方程, 能够解析出各个污染源的后验分布特征, 最后得出的各污染源贡献率为一个概率分布(Parnell et al., 2010)。近几十年来,为了克服单一氮同位素对地下水氮源识别的局限,基于δ15N和δ18O的双硝酸盐同位素混合模型与SIAR模型分析已被用作识别水体中硝酸盐污染物来源的有效方法,成功地追踪地下水、湿地、河流和湖泊中的氮源(Jung et al., 2020)。Duan et al.(2023)利用氮、氧双同位素方法对渭河下游地下水硝酸盐来源进行研究,结果表明其主要来源为NH4+、大气降雨、肥料、土壤氮和动物粪便中的硝酸盐,并借助SIAR模型量化得出:不同地貌类型中43.7%和59.1%的动物粪便和生活污水是河滩和冲积平原地下水硝酸盐的主要来源,55.5%的大气沉降是黄土高原地下水硝酸盐的主要来源。
5.2 大气的氮源识别
氮氧化物(NOx=NO+NO2)是HNO3的前体(Alexander and Mickley, 2015),是主要的大气污染物。除了氮氧化物之外,NH3也是参与大气氮循环的关键成分之一,可与大气中的SO2和NOx等反应生成硝酸铵、硫酸铵等二次污染物,这些物质均是大气PM2.5的重要组成部分,在雾霾的形成中具有重要作用(Jiang et al., 2021)。NOx来自闪电、生物质燃烧和土壤排放等自然来源,以及化石燃料中氮的氧化等人为来源。人为来源的NOx的δ15N值为正值,而牲畜粪便和施肥土壤等农业来源的NOx的δ15N值为负值(表14),这是由于与硝化和反硝化相关的氮同位素分馏更显著(Choi et al., 2017)。气态NH3的δ15N取决于来源,但通常很低,因为挥发是一个单向过程,伴随着同位素分馏,导致强烈15N耗尽的NH3排放到大气中。施肥土壤、畜粪和有机废物挥发的NH3的δ15N远低于化石燃料燃烧排放的δ15N(表14)。由于NH3和NOx的来源和生成过程不同,NH3的平均δ15N(−27.6‰)显著低于NOx(−9.0‰),反映了NH3挥发相关过程的氮同位素分馏高于NOx生成过程。
表 14 不同排放源大气氮δ15N值(据Choi et al., 2023)Table 14. Atmospheric nitrogen δ15N values of different emission sources (after Choi et al., 2023)来源 δ15N−NOx/‰ δ15N−NH3/‰ 生物质燃烧 0.2 化石燃料燃烧 11.7 −13 施肥土壤 −32.5 −40.5 牲畜粪便 −19.3 −27.9 车辆 −8.2 −21.7 天然气燃烧 −16.7 有机废物 −37.8 目前同位素混合模型、SIAR模型是HNO3或NOx排放源追溯的主要方法。Song et al.(2021)利用SIAR模型评估了化石燃料和非化石燃料来源的NOx对大气HNO3的相对贡献,结果表明,在美国、智利、法国、日本和中国的研究地点,NOx转化为HNO3的同位素分馏效应值从(12.0±1.7)‰到(23.9±6.1)‰不等。NOx的来源为化石燃料燃烧、汽车尾气、微生物氮循环和生物质燃烧,其同位素分馏效应值的范围分别为(2±1)%~(28±10)%,( 24±11)%~(40±8)%,( 18±5)%~(56±2)%,化石燃料和非化石燃料,其同位素分馏效应值的NOx排放比例具有可比性,但由于化石燃料燃烧站点与空间分布的影响仍然具有部分不确定性。
15N同位素示踪技术也被广泛应用于NH3或NH4+源解析领域,通过测定NH3或NH4+的δ15N值,采用同位素混合模型计算各主要排放源对大气NH3或NH4+的相对贡献。例如,Berner and Felix(2020)通过测定δ15N−NH3对NH3来源进行研究,发现非农业源对美国城市大气氮贡献高达(55±6)%。中国关于NH3和NH4+的δ15N源解析研究大多数在中国北方城市,少数研究集中在南方地区。例如Pan et al.(2016)建立了大气NH3的δ15N−NH4+源解析方法,揭示了化石燃料排放NH3是北京城市雾霾期的最大来源,其贡献比例高达90%。
6. 结 论
目前国内外对氮同位素在生态环境中的研究重点多在土壤氮循环及微生物学过程;植物对氮素的利用;利用同位素混合模型、SIAR模型进行水体与大气氮源解析并评价其环境效应上。氮稳定同位素的应用领域从土壤、植物等自然生态系统逐渐扩大到地表水、地下水及大气系统。随着科学技术的发展,我们对陆地氮循环的理解正在发生变化。未来应在以下几个方面进行更深入的研究:
(1)目前大多数研究认为陆地生态系统氮输入来源仅有生物固氮与大气氮沉降过程,然而已经有证据表明岩石风化同样对氮的输入产生贡献。因此,我们应当将岩石风化释放的氮纳入生态氮循环过程中,探索岩石衍生氮的输入对其他氮输入途径的限制以及植物吸收岩石衍生氮的形式与机制。
(2)氮素周转过程除了矿化作用与硝化作用外,还包括少部分的硝酸盐异化还原成铵作用(DNRA),目前这方面研究较少,关于硝酸盐异化还原成铵作用的环境控制以及这一过程在生物气候带和土壤类型的广泛程度仍然存在问题。
(3)虽然我们认识到植物可以吸收矿物质和有机形式的氮,但对有机与矿物质的氮吸收量以及不同形式的氮的吸收如何因植物器官、物种和环境而异的理解有限,评估这一问题需要科学家们探索新的手段与工具。
(4)植物的性状在种群之间具有显著差异,因此植物性状的变异或进化会限制种内或种间的氮利用,然而基因与环境在控制资源利用性状方面的作用尚未探索。
(5)未来需要提高在测量氮循环过程中量化不确定性来源的能力,确定未被发现的氮输入、积累和损失途径,完善并发展生态系统氮循环模型。
-
图 1 主要氮循环过程中的同位素分馏效应(ε,δ15N/‰)(据张金波等,2022)
Figure 1. Isotopic fractionation in major nitrogen cycles (ε, δ15N/‰) (after Zhang Jinbo et al., 2022)
图 3 温度(a,据Yun et al., 2011)和湿度影响下土壤硝化过程氮同位素分馏系数变化(b,据Yun and Ro, 2014)
Figure 3. Changes of nitrogen isotope fractionation coefficient in soil nitrification process under the influence of temperature (a, after Yun et al., 2011) and humidity (b, after Yun and Ro, 2014)
图 4 δ15N−NH4+随NH4+受硝化作用和同化作用影响的变化(据Choi et al., 2017)
Figure 4. Change of δ15N−NH4+ as NH4+ is affected by the contribution of nitrification and assimilation (after Choi et al., 2017)
图 8 不同气候带土壤氮矿化速率
白色数字为观测个数(据Elrys et al., 2021)
Figure 8. Soil nitrogen mineralization rates in different climatic zone
White numbers are the number of observations (after Elrys et al., 2021)
图 9 土壤氮周转速率影响因素
橙色箭头代表正相关,蓝色箭头代表负相关,箭头越粗表明相关性越大(据Li et al., 2020修改)
Figure 9. Factors affecting soil nitrogen turnover rate
The orange arrow represents a positive correlation, the blue arrow represents a negative correlation, and the thicker the arrow, the greater the correlation (modified from Li et al., 2020)
图 10 不同生态系统氮矿化速率(N为观测值个数;据Elrys et al., 2021)
Figure 10. Nitrogen mineralization rate in different ecosystems (N is the number of observations; after Elrys et al., 2021)
图 11 土壤N2O产生途径(据Baggs, 2008)
Figure 11. The process of soil N2O production (after Baggs, 2008)
图 12 土壤孔隙水含量(a,据Wang et al., 2023)与pH(b,据Zhang et al., 2021)对硝化和反硝化作用对N2O生成贡献的影响
Figure 12. Effects of soil water filled pore space (a, after Wang et al., 2023) and pH (b, after Zhang et al., 2021) on the contribution of nitrification and denitrification to N2O production
图 13 土壤15N−N2O(a)与土壤排放气体N2O/N2(b)随温度变化(据Lai et al., 2019)
Figure 13. Soil 15N−N2O (a) and soil emission of N2O/N2 (b) varies with temperature (after Lai et al., 2019)
图 14 不同土壤类型产生N2O的15N丰度(据Zhang et al., 2017)
Figure 14. Different soil types produce 15N abundance of N2O (after Zhang et al., 2017)
图 15 不同土壤类型N2O产生途径nh、na和nd分别是异养硝化、自养硝化和反硝化对N2O生成的贡献(据Zhang et al., 2018)
Figure 15. Pathway of N2O production in different soil types nh, na and nd are the contribution of heterotrophic nitrification, autotrophic nitrification and denitrification to N2O production, respectively (after Zhang et al., 2018)
图 16 干旱、亚热带和温带气候带的澳大利亚森林土壤N2O产生途径
nh、na和nd分别是异养硝化、自养硝化和反硝化对N2O生成的贡献(据Pan et al., 2022)
Figure 16. N2O production pathways in Australian forest soils from arid, subtropical and temperate climatic zones
nh, na and nd are the contribution of heterotrophic nitrification, autotrophic nitrification and denitrification to N2O production, respectively (after Pan et al., 2022)
图 17 作物生物固氮过程(据Guo et al., 2023)
Figure 17. Biological nitrogen fixation in crops (after Guo et al., 2023)
图 18 氮沉降与不同地区森林叶片δ15N的相关性(据Choi et al., 2023)
Figure 18. Correlation between nitrogen deposition and δ15N of forest leaves in different regions (after Choi et al., 2023)
图 19 北美森林(a)与热带森林(b)不同树种树轮δ15N变化趋势比较(据王可逸等,2021)
Figure 19. Comparison in the regional trends of global tree-ring δ15N in North American forests (a) and tropical forests(b) (after Wang Keyi et al., 2021)
图 20 温带地区(a)和冷温带白桦和泥炭藓(b)吸收氮偏好(据Gao et al., 2020)
Figure 20. Preference for nitrogen uptake by birch and sphagnum moss in temperate zones (a) and cold temperate zones(b) (after Gao et al., 2020)
图 21 不同污染来源δ15N值分布(据Xue et al., 2009)
Figure 21. Typical ranges of δ15N values from different pollution sources (after Xue et al., 2009)
图 22 不同污染来源δ15N与δ18O值分布(据Kendall, 1998)
Figure 22. Typical ranges of δ15N and δ18O values from different pollution sources (after Kendall, 1998)
图 23 典型污染来源δ15N与δ11B值分布(据Sankoh et al., 2022)
Figure 23. Typical δ15N and δ11B values from different pollution sources (after Sankoh et al., 2022)
表 1 不同细菌在不同实验条件下反硝化作用的氮同位素分馏效应(ε,δ 15N/‰)
Table 1 Nitrogen isotope fractionation effect of denitrification by different bacteria under different experimental conditions (ε, δ 15N/‰)
表 2 同种细菌在不同实验条件下反硝化作用的氮同位素分馏效应(ε,δ 15N/‰)(据Frey et al., 2014;Treibergs and Granger, 2017)
Table 2 Nitrogen isotope fractionation effect of denitrification by the same bacteria under different experimental conditions (ε, δ 15N/‰) (after Frey et al., 2014; Treibergs and Granger, 2017)
细菌 温度/
℃NO3−浓度/
mM细菌数量/
个氮同位素分馏效应
(ε,δ 15N/‰)脱氮副球菌 20 0.2 4 22.90 20 0.2 4 25.80 20 1 3 33.00 20 1 5 31.50 硫单胞菌 15 5 5 24.29 15 5 4 21.17 15 1 5 17.69 10 1 5 13.08 10 1 5 13.08 表 3 不同生态系统反硝化作用氮同位素分馏效应
Table 3 Denitrification effect of nitrogen isotope fractionation in different ecosystems
表 4 不同生态系统平均硝化速率(据Li et al., 2020)
Table 4 Average nitrification rate in different ecosystems (after Li et al., 2020)
生态系统 平均硝化速率/(mg/kg/d) 观测数据/个 农田 3.82 1423 森林 2.58 841 草地 1.70 368 湿地 3.29 80 表 5 不同N2O产生过程中δ15N与SP值(据Decock and Six, 2013)
Table 5 Different N2O production processes of δ15N and SP values (after Decock and Six, 2013)
N2O产生过程 δ15N/‰ SP 氨氧化细菌羟氨氧化 −0.3±3.4 33.0±1.6 甲烷氧化菌羟氨氧化 1.9±1.9 32.7±5.0 氨氧化细菌氨氧化 −45.5±2.3 31.4±4.2 非生物氧化 −5.8±9.2 29.9±1.5 真菌反硝化作用 −9.9±6.7 35.2±4.3 反硝化作用 −13.8±4.9 −2.2±3.2 硝化细菌反硝化作用 −29.0±6.0 −1.0±4.3 表 6 全球范围内不同气候带和海拔范围内的土壤δ15N统计特征值(据昝麒麟等,2022)
Table 6 Number of samples and statistical descriptions of soil δ15N on global scale in different climate zones and elevation ranges (after Zan Qilin et al., 2022)
土壤环境 土壤δ15N值/‰ 气候带 赤道气候带 5.34 干旱气候带 5.78 暖温气候带 3.91 冷温气候带 3.98 极地气候带 3.98 海拔 <500 m 4.39 500~1000 m 4.70 1000~2000 m 4.72 2000~3500 m 4.78 >3500 m 4.18 表 7 不同种类肥料δ15N值(据Choi et al., 2017)
Table 7 δ15N values of different kinds of fertilizers (after Choi et al., 2017)
肥料种类 δ15N/‰ 平均δ15N/‰ 合成肥料 尿素 −5.9~1.9 −1.2 ± 0.4 硫酸铵 −3.9~6.6 −0.5 ± 0.7 硝酸铵 −1.7~2.6 0.1 ± 0.5 牲畜粪便 牛粪 3.5~16.5 8.4 ± 0.9 猪粪 4.4 ~11.3 6.7 ± 1.0 马粪 7.2~11.8 9.5 ± 2.3 家禽粪便 2.7~14.6 7.1 ± 1.5 表 8 利用氮同位素技术提高作物相关微生物固氮的研究现状
Table 8 Research status of nitrogen isotope technology to improve nitrogen fixation by crop−related microorganisms
作物种类 研究现状 参考文献 水稻 利用15N直接标记测定稻田固氮量,发现水稻种植极大地促进了固氮菌nifH基因的表达,提高了固氮菌的固氮活性,增加了稻田各层土壤的固氮量 张燕辉等(2021) 玉米 利用15N自然丰度法进行实验证明,墨西哥玉米品种ierra Mixe根部产生的黏液中具有活性nif基因的细菌菌株,可以满足该玉米品种氮需求的29%~82% Van Deynze et al. (2018) 将氮肥替换为30% atom15N标记的(NH4)2SO4,测定γ−变形杆菌通过生物固氮贡献了玉米茎中积累的11.8%的总氮 Zhang et al. (2022) 甘蔗 利用15N自然丰度法确定接种重氮营养菌使RB92579和RB2003两种甘蔗品种的生物固氮量分别增加了50和17 kg/hm2 Martins et al. (2020) 通过对植株组织、植株产物和叶绿素的15N同位素稀释,证实了克莱伯菌与甘蔗共生,能缓解氮素缺乏症的发生 Luo et al. (2015a) 豆类 利用15N贫化法确定接种根瘤菌有利于提高籽粒固氮和籽粒重。与Apore品种相比,Ouro Negro品种的根瘤数量和重量以及从大气中获得的氮量更高 Silva et al. (2017) 表 9 不同大陆和气候带森林的大气氮沉降速率(据Schwede et al., 2018)
Table 9 Atmospheric N deposition rates for forests in different continents and climate zones (after Schwede et al., 2018)
气候带 地区 氮沉降速率/(kg/hm2/a) 亚洲 7.8 温带 美洲 5.4 欧洲 10.8 亚洲 29.3 北美洲 7.2 亚热带 南美洲 10.5 欧洲 10.5 非洲 7.9 热带 亚洲 11.8 北美洲 7.4 南美洲 5.8 欧洲 7.1 表 10 不同地区植物叶片的δ15N和氮含量(据Choi et al., 2023)
Table 10 δ15N and N concentration of foliage in different zones (after Choi et al., 2023)
气候带 叶片δ15N/‰ 叶片氮含量/(g/kg) 温带 −2.4±2.2 16.4±5.2 亚热带 −2.5±2.0 14.6±5.0 热带 1.6±4.3 18.5±7.3 表 11 入侵物种对土壤有效氮的影响
Table 11 Effects of invasive species on soil available nitrogen
地区 入侵物种 对土壤有效氮影响 参考文献 北美 矢车菊 根系分泌儿茶素显著抑制土壤硝化速率,导致入侵地土壤NO3−浓度降低 Thorpe and Callaway,2011 北美 虎杖 分泌单宁抑制土壤的氮矿化作用,导致土壤无机氮浓度较低,总游离氨基酸和可溶性有机氮的浓度升高 Tharayil et al.,2013 中国北方 火炬树 提高土壤的硝化速率,土壤NO3−含量升高,土壤NH4+含量降低 黄乔乔等,2013 海南 金钟藤 土壤NO3−、NH4+含量升高 纵熠等,2015 澳大利亚 须芒草 提高土壤氨化作用,抑制土壤氮硝化,土壤NH4+含量增加 Rossiter−Rachor et al.,2009 表 12 不同地区小麦样品δ15N值(据Luo et al., 2015b)
Table 12 δ15N values of wheat samples from different regions (after Luo et al., 2015b)
来源 δ15N/‰ 美国 3.04±0.79 加拿大 2.13±0.70 澳大利亚 7.25±1.18 中国 2.45±0.5 表 13 不同地区谷物δ15N与δ13C值(据Wu et al., 2015)
Table 13 δ15N and δ13Cvalues of different cereal grains from different origins (after Wu et al., 2015)
谷物 平均δ15N/‰ 平均δ13C/‰ 黑龙江 山东 江苏 黑龙江 山东 江苏 水稻 3.070 3.434 3.221 −26.285 −26.946 −27.578 大豆 1.365 1.462 1.388 −23.679 −25.642 −26.102 小米 1.098 1.251 1.112 −11.985 −12.346 −12.897 小麦 1.827 1.934 1.850 −22.843 −25.694 −25.162 玉米 0.237 0.432 0.292 −10.965 −10.444 −11.292 表 14 不同排放源大气氮δ15N值(据Choi et al., 2023)
Table 14 Atmospheric nitrogen δ15N values of different emission sources (after Choi et al., 2023)
来源 δ15N−NOx/‰ δ15N−NH3/‰ 生物质燃烧 0.2 化石燃料燃烧 11.7 −13 施肥土壤 −32.5 −40.5 牲畜粪便 −19.3 −27.9 车辆 −8.2 −21.7 天然气燃烧 −16.7 有机废物 −37.8 -
[1] Ahmed M, Aly A, Gomaa H. 2012. Developed method for nitrate extraction and purification to measure δ18O−NO3−composition in water[J]. Arab Journal of Nuclear Sciences and Applications, 45(4): 1−13.
[2] Alexander B, Mickley L J. 2015. Paleo−perspectives on potential future changes in the oxidative capacity of the atmosphere due toclimate change and anthropogenic emissions[J]. Current Pollution Reports, 1(2): 57−69. doi: 10.1007/s40726-015-0006-0
[3] An H, Li G Q. 2015. Efects of grazing on carbon and nitrogen in plants and soils in a semiarid desert grassland, China[J]. Journal of Arid Land, 7(3): 341−349. doi: 10.1007/s40333-014-0049-x
[4] Aranibar J N, Otter L, Macko S A, Epstein H E, Otter L, Dowty P R. 2004. Nitrogen cycling in the soil−plant system along a precipitation gradient in the Kalahari sands[J]. Global Change Biology, 10(3): 359−373. doi: 10.1111/j.1365-2486.2003.00698.x
[5] Archana A, Thibodeau B, Geeraert N, Xu M N, Kao S J, Baker D M. 2018. Nitrogen sources and cycling revealed by dual isotopes of nitrate in a complex urbanized environment[J]. Water Research, 142: 459−470. doi: 10.1016/j.watres.2018.06.004
[6] Baggs E M. 2008. A review of stable isotope techniques for N2O source partitioning in soils: Recent progress, remaining challenges and future considerations[J]. Rapid Communications in Mass Spectrometry, 22: 1664−1672. doi: 10.1002/rcm.3456
[7] Bai X, Hu X J, Liu J J, Wei D, Zhu P, Cui X, Zhou B K, Chen X L, Liu J D, Jin J, Liu X B, Wang G H. 2022. Ammonia oxidizing bacteria dominate soil nitrification under different fertilization regimes in black soils of northeast China[J]. European Journal of Soil Biology, 111: 103410. doi: 10.1016/j.ejsobi.2022.103410
[8] Berner A H, Felix J D. 2020. Investigating ammonia emissions in a coastal urban airshed using stable isotope techniques[J]. The Science of the Total Environment, 707: 134952. doi: 10.1016/j.scitotenv.2019.134952
[9] Booth M S, Stark J M, Rastetter E. 2005. Controls on nitrogen cycling in terrestrial ecosystems: A synthetic analysis of literature data[J]. Ecological Monographs, 75(2): 139−157. doi: 10.1890/04-0988
[10] Bork E W, Attaeianb B, Cahillc J F, Changd S X. 2019. Soil nitrogen and greenhouse gas dynamics in a temperate grassland under experimental warming and defoliation[J]. Soil Science Society of America Journal, 83(3): 780−790. doi: 10.2136/sssaj2018.04.0150
[11] Briand C, Plagnes, V, Sebilo M, Louvat P, Chesnot T, Schneider M, Ribstein P, Marchet P. 2013. Combination of nitrate(N, O) and boron isotopic ratios with microbiological indicators for the determination of nitrate sources in karstic groundwater[J]. Environmental Chemistry, 10(5): 365−369. doi: 10.1071/EN13036
[12] Briand C, Sebilo M, Louvat P, Chesno T, Vaury V, Schneider M, Plagnes V. 2017. Legacy of contaminant N sources to the NO3−signature in rivers: a combined isotopic (δ15N−NO3−, δ18O−NO3−, δ11B) and microbiological investigation[J]. Scientific Reports, 7: 41703. doi: 10.1038/srep41703
[13] Buchen C, Lewicka−Szczebak D, Flessa H, Well R. 2018. Estimating N2O processes during grassland renewal and grassland conversion to maize cropping using N2O isotopocules[J]. Rapid Communications in Mass Spectrometry, 32(13): 1053−1067. doi: 10.1002/rcm.8132
[14] Byrnes R C, Nùnez J, Arenas L, Rao I, Trujillo C, Alvarez C. 2017. Biological nitrification inhibition by Brachiaria grasses mitigates soil nitrous oxide emissions from bovine urine patches[J]. Soil Biology & Biochemistry, 107(1): 156−163.
[15] Cao Yacheng, Zhang Jinbo, Wen Teng. 2018. Application of Stable Isotope Tracer Technology and Mass Spectrometry in Soil, Ecology and Environment Research [M]. Beijing: Science Press (in Chinese).
[16] Chalk P, Smith C. 2021. On inorganic N uptake by vascular plants: Can 15N tracer techniques resolve the NH4+ versus NO3− “preference” conundrum?[J]. European Journal of Soil Science, 72(4): 1762−1779. doi: 10.1111/ejss.13069
[17] Chapagain T, Riseman A. 2014. Barley−pea intercropping: Effects on land productivity, carbon and nitrogen transformations[J]. Field Crops Research, 166: 18−25. doi: 10.1016/j.fcr.2014.06.014
[18] Chen Z M, Ding W X, Xu Y H, Müller C, Rütting T, Yu H Y, Fan J L, Zhang J B, Zhu T B. 2015. Importance of heterotrophic nitrification and dissimilatory nitrate reduction to ammonium in a cropland soil: Evidences from a 15N tracing study to literature synthesis[J]. Soil Biology and Biochemistry, 91: 65−75. doi: 10.1016/j.soilbio.2015.08.026
[19] Chen Z X, Liu G, Liu W G, Lam M H W, Liu G J, Yin X B. 2012. Identification of nitrate sources in Taihu Lakeand its major inflow rivers in China, using δ15N−NO3− and δ18O−NO3− values[J]. Water Science & Technology, 66(3): 536−542.
[20] Cheng Y, Wang J, Chang S X, Cai Z C, Müller C, Zhang J B. 2019. Nitrogen deposition affects both net and gross soil nitrogen transformations in forest ecosystems: A review[J]. Environmental Pollution (Barking, Essex: 1987), 244: 608−616.
[21] Cheng Y, Wang J, Wang S Q, Zhang J B, Cai Z C. 2014. Effects of soil moisture on gross N transformations and N2O emission in acid subtropical forest soils[J]. Biology and Fertility of Soils, 50(7): 1099−1108. doi: 10.1007/s00374-014-0930-y
[22] Choi W J, Kwak J H, Lim S S, Park, H J, Chang S X, Lee S M, Arshad M A, Yun S I, Kim H Y. 2017. Synthetic fertilizer and livestock manure differently affect δ15N in the agricultural landscape: A review[J]. Agriculture, Ecosystems & Environment, 237: 1−15.
[23] Choi W J, Kwak J H, Park H J, Yang H I, Park S I, Xu Z, Lee S M, Lim S S, Chang S X. 2020. Land−use type, and land management and disturbance affect soil δ15N: A review[J]. Soils Sediments, 20: 3283−3299. doi: 10.1007/s11368-020-02708-x
[24] Choi W J, Lee S M, Chang S X, Ro H M. 2005. Variations of δ13C and δ15N in Pinus Densiflora tree−rings and relationship to environmental changes in eastern Korea[J]. Water Air and Soil Pollution, 164(1): 173−187.
[25] Choi W J, Park H J, Baek N, Yang H I, Kwak J H, Lee S, Park S W, Shin E S, Lim S S. 2023. Patterns of δ15N in forest soils and tree foliage and rings between climate zones in relation to atmospheric nitrogen deposition: A review[J]. Science of the Total Environment, 900: 165866. doi: 10.1016/j.scitotenv.2023.165866
[26] Choi W J, Ro H M. 2003. Differences in isotopic fractionation of nitrogen in water−saturated and unsaturated soils[J]. Soil Biology & Biochemistry, 35(3): 483−486.
[27] Cookson W R, Osman M, Marschner P, Abaye D A , Clark I, Murphy D V, Stockdale E A, Watson C A. 2007. Controls on soil nitrogen cycling and microbial community composition across land use and incubation temperature[J]. Soil Biology and Biochemistry, 39(3): 744−756.
[28] Craine J, Brookshire E, Cramer M, Hasselquist N, Koba K, Marin−Spiotta E, Wang L X. 2015. Ecological interpretations of nitrogen isotope ratios of terrestrial plants and soils[J]. Plant and Soil, 396(1/2): 1−26.
[29] Craine J M, Elmore A J, Wang L X. 2018. Isotopic evidence for oligotrophication of terrestrial ecosystems[J]. Nature Ecology & Evolution, 2: 1735−1744.
[30] Dähnke K, Thamdrup B. 2016. Isotope fractionation and isotope decoupling during anammox and denitrification in marine sediments[J]. Limnology and Oceanography, 61(2): 610−624. doi: 10.1002/lno.10237
[31] Decock C, Six J. 2013. How reliable is the intramolecular distribution of 15N in N2O to source partition N2O emitted from soil?[J]. Soil Biology and Biochemistry, 65: 114−127. doi: 10.1016/j.soilbio.2013.05.012
[32] Denk T R A, Butterbach−Bahl K, Kiese R, Wolf B, Mohn J, Harris E Decock C, Lewicka−Szczebak Dominika. 2017. The nitrogen cycle: A review of isotope effects and isotope modeling approaches[J]. Soil Biology & Biochemistry, 105: 121−137.
[33] Deutsch B, Mewes M, Liskow I, Voss M. 2006. Quantification of diffuse nitrate inputs into a small river system using stable isotopes of oxygen and nitrogen in nitrate[J]. Organic Geochemistry, 37(10): 1333−1342. doi: 10.1016/j.orggeochem.2006.04.012
[34] Ding J T, Xi B D, Gao R T, He L Sg, Liu H L, Dai X L, Yu Y J. 2014. Identifying diffused nitrate sources in a stream in an agricultural field using a dual isotopic approach[J]. Science of The Total Environment, 484: 10−18. doi: 10.1016/j.scitotenv.2014.03.018
[35] Du E, Terrer C, Pellegrini A F A, Ahlström A, Lissa C J V, Zhao Xia, Xia Nan, Wu Xinhui, Jackson R B. 2020. Global patterns of terrestrial nitrogen and phosphorus limitation[J]. Nature Geoscience, 13(3): 221−226. doi: 10.1038/s41561-019-0530-4
[36] Duan L, Wu Y K, Fan J H, Ye F, Xie C C, Fu X Y, Sun Y Q. 2023. Identification of nitrogen pollution sources and transport transformation processes in groundwater of different landforms using C, H, N, and O isotope techniques: An example from the lower Weihe River[J]. Environmental Science and Pollution Research International, 30(11): 1614−7499.
[37] Elrys A S, Ali A, Zhang H M, Cheng Y, Zhang J B, Cai Z C, Müller C, Chang S X. 2021. Patterns and drivers of global gross nitrogen mineralization in soils[J]. Global Change Biology, 27(22): 5950−5962. doi: 10.1111/gcb.15851
[38] Escanhoela A S B, Pitombo L M, Brandani C B, Navarrete A A, Bento C B, do Carmo J B. 2019. Organic management increases soil nitrogen but not carbon content in a tropical citrus orchard with pronounced N2O emissions[J]. Journal of Environmental Management, 234: 326−335. doi: 10.1016/j.jenvman.2018.11.109
[39] Feng Xiaomin, Gao Xiang, Zang Huadong, Hu Yuegao, Ren Changzhong, Hao Zhiping, Lü Huiqing, Zeng Zhaohai. 2023. Effects of oat and mung bean intercropping and nitrogen transfer characteristics[J]. Chinese Bulletin of Botany, 58(1): 122−131 (in Chinese with English abstract).
[40] Frey C, Hietanen S, Jürgens K, Labrenz M, Voss Maren. 2014. N and O isotope fractionation in nitrate during chemolithoautotrophic denitrification by sulfurimonas gotlandica[J]. Environmental Science & Technology, 48(22): 13229−13237.
[41] Fukada T, Hiscock K M, Dennis P F, Grischek T. 2003. A dual isotope approach to identify denitrification in groundwater at a river−bank infiltration site[J]. Water Research, 37(13): 3070−3078. doi: 10.1016/S0043-1354(03)00176-3
[42] Gao L, Cui X Y, Hill P W, Guo T F. 2020. Uptake of various nitrogen forms by co−existing plant species in temperate and cold−temperate forests in northeast China[J]. Applied Soil Ecology, 147: 103398. doi: 10.1016/j.apsoil.2019.103398
[43] Gao W, Yan D. 2019. Warming suppresses microbial biomass but enhances N recycling[J]. Soil Biology and Biochemistry, 131: 111−118. doi: 10.1016/j.soilbio.2019.01.002
[44] Gerhart L M, McLauchlan K K. 2014. Reconstructing terrestrial nutrient cycling using stable nitrogen isotopes in wood[J]. Biogeochemistry, 120(1): 1−21.
[45] Groffman P M, Altabet M A, Böhlke J K. 2006. Methods for measuring denitrification: Diverse approaches to a difficult problem[J]. Ecological Applications, 16(6): 2091−2122. doi: 10.1890/1051-0761(2006)016[2091:MFMDDA]2.0.CO;2
[46] Guo K Y, Yang J, Yu N, Luo L, Wang E T. 2023. Biological nitrogen fixation in cereal crops: Progress, strategies and perspectives[J]. Plant Communications, 4(2): 100499 doi: 10.1016/j.xplc.2022.100499
[47] Halm H, Lam P, Ferdelman T G, Lavik G, Dittmar T, LaRoche J, D’Hondt S, Kuypers M M M. 2012. Heterotrophic organisms dominate nitrogen fixation in the South Pacific Gyre[J]. The ISME Journal, 6(6): 1238−1249. doi: 10.1038/ismej.2011.182
[48] Hastings M G, Casciotti K L, Elliott E M. 2013. Stable isotopes as tracers of anthropogenic nitrogen sources, deposition, and impacts[J]. Elements, 9(5): 339−344. doi: 10.2113/gselements.9.5.339
[49] Hauggaard−Nielsen H, Gooding M, Ambus P, Corre−Hellou G, Crozat Y, Dahlmann C, Dibet A, Von Fragstein P, Pristeri A, Monti M, Jensen E S. 2009. Pea–barley intercropping for efficient symbiotic N2−fixation, soil N acquisition and use of other nutrients in European organic cropping systems[J]. Field Crops Research, 113(1): 64−71. doi: 10.1016/j.fcr.2009.04.009
[50] Hoefs J. 2021. Stable Isotope Geochemistry[M]. BerLin: Springer International Publishing.
[51] Hosono T, Alvarez K, Li I T, Shimada J. 2015. Nitrogen, carbon, and sulfur isotopic change during heterotrophic (Pseudomonas aureofaciens) and autotrophic (Thiobacillus denitrificans) denitrification reactions[J]. Journal of Contaminant Hydrology, 183: 72−81. doi: 10.1016/j.jconhyd.2015.10.009
[52] Hu H W, Xu Z H, He J Z. 2014. Ammonia−oxidizing archaea play a predominant role inacid soil nitrification[J]. Advances in Agronomy, 125: 261−302.
[53] Huang Qiaoqiao, Xu Hui, Fan Zhiwei, Hou Yuping. 2013. Effects of loblolly tree invasion on soil chemical properties of young black pine forest[J]. Journal of Ecology and Environment, 22(7): 119−1123 (in Chinese).
[54] Huang T, Gao B, Hu X K, Lu X, Well R, Christie P, Bakken L R, Ju X T. 2014. Ammonia−oxidation as an engine to generate nitrous oxide in an intensively managed calcareous fluvo−aquic soil[J]. Scientific Reports, 4(1): 3950. doi: 10.1038/srep03950
[55] Jeong Y J, Park H J, Jeon B J, Seo B S, Baek N, Yang H I, Kwak J H, Lee S M, Choi W J. 2022. Land use types with diferent fertilization management affected isotope ratios of bulk and water−extractable C and N of soils in an intensive agricultural area[J]. Soils Sediments, 22: 429−442. doi: 10.1007/s11368-021-03097-5
[56] Jiang L L, Wang S P, Pang Z, Wang C S, Kardol P, Zhou X Q, Rui Y C, Lan Z C, Wang Y F, Xu X L. 2015. Grazing modifies inorganic and organic nitrogen uptake by coexisting plant species in alpine grassland[J]. Biology & Fertility of Soils, 52(2): 211−221.
[57] Jiang Y Q, Xing J, Wang S X, Chang X, Liu S C, Shi A J, Liu B X, Sahu S K. 2021. Understand the local and regional contributions on air pollution from the view of human health impacts[J]. Frontiers of Environmental Science & Engineering, 15(5): 88.
[58] Jung H J, Koh D C, Yun S K, Jeen S W, Lee J. 2020. Stable isotopes of water and nitrate for the identification of groundwater flowpaths: A review[J]. Water, 12(1): 138. doi: 10.3390/w12010138
[59] Kaushal R, Hsueh Y H, Chen C L, Lan Y P, Wu P Y, Chen Y C, Liang M C. 2022. Isotopic assessment of soil N2O emission from a sub−tropical agricultural soil under varying N−inputs[J]. Science of the Total Environment, 827: 154311. doi: 10.1016/j.scitotenv.2022.154311
[60] Kellman L M. 2005. A study of tile drain nitrate−δ15N values as a tool for assessing nitrate sources in an agricultural region[J]. Nutrient Cycling in Agroecosystems, 71(2): 131−137. doi: 10.1007/s10705-004-1925-0
[61] Kemmitt S J, Wright D, Goulding K W, Jones D L. 2006. pH regulation of carbon and nitrogen dynamics in two agricultural soils[J]. Soil Biology & Biochemistry, 38(5): 898−911.
[62] Kendall C, Elliott E M, Wankel S D. 2007. Tracing anthropogenic inputs of nitrogen to ecosystems[J]. Stable Isotopes in Ecology and Environmental Science: 375−449.
[63] Kendall C. 1998. Chapter 16−Tracing Nitrogen Sources and Cycling in Catchments. Isotope Tracers in Catchment Hydrology [M]. Elsevier Science, 519−576.
[64] Kuypers M M M, Marchant H K, Kartal B. 2018. The microbial nitrogen−cycling network[J]. Nature Reviews Microbiology, 16: 263−276. doi: 10.1038/nrmicro.2018.9
[65] Kwak J H, Lim S S, Chang S X, Lee K H. 2011. Potential use of δ13C, δ15N, N concentration, and Ca/Al of Pinus densiflora tree rings in estimating historical precipitation pH[J]. Soils Sediments, 11(5): 709−721. doi: 10.1007/s11368-011-0355-2
[66] Ladha J K, Tirol−Padre A, Reddy C K, Cassman K G, Verma S, Powlson D S, Kessel C V, Richter D B, Chakraborty D, Pathak H. 2016. Global nitrogen budgets in cereals: A 50−year assessment for maize, rice, and wheat production systems[J]. Scientific Reports, 6(1): 19355 doi: 10.1038/srep19355
[67] Lai T V, Farquharson R, Denton M D. 2019. High soil temperatures alter the rates of nitrification, denitrification and associated N2O emissions[J]. Journal of Soils and Sediments, 19(5): 2176−2189. doi: 10.1007/s11368-018-02238-7
[68] Lang M, Li P, Ti C, Zhu S, Yan X, Chang S X. 2019. Soil gross nitrogen transformations are related to land−uses in two agroforestry systems[J]. Ecological Engineering, 127: 431−439. doi: 10.1016/j.ecoleng.2018.12.022
[69] Lehmann M F. Email Author, Reichert P, Bernasconi S M, Barbieri A, McKenzie J A. 2003. Modelling nitrogen and oxygen isotope fractionation during denitrification in a lacustrine redox−transition zone[J]. Geochimica et Cosmochimica Acta, 67(14): 2529−2542. doi: 10.1016/S0016-7037(03)00085-1
[70] Lewicka−Szczebak D, Well R, Koster J R , Fuß R, Senbayram M, Dittert K, Flessa H. 2014. Experimental determinations of isotopic fractionation factors associated with N2O production and reduction during denitrification in soils[J]. Geochimica et Cosmochimica Acta, 134(1): 55−73.
[71] Li C, Jiang Y B, Guo X Y, Cao Y, Ji H B. 2014. Multi−isotope (15N, 18O and 13C) indicators of sources and fate of nitrate in the upper stream of Chaobai River, Beijing, China[J]. Environmental Sciences: Processes and Impacts, 16(11): 2644−2655. doi: 10.1039/C4EM00338A
[72] Li Siliang, Liu Congqiang, Xiao Huayun. 2002. A review of studies on microbial action and isotope fractionation in nitrogen cycle in surface environment[J]. Geology−Geochemistry, 30(4): 40−45 (in Chinese with English abstract).
[73] Li S, Gurmesa G A, Zhu W. 2019. Fate of atmospherically deposited NH4+ and NO3− in two temperate forests in China: Temporal pattern and redistribution[J]. Ecological Applications: A Publication of the Ecological Society of America, 29(6): e01920. doi: 10.1002/eap.1920
[74] Li Zhaolei, Zeng Zhaoqi, Tian Dashuan, Wang Jinsong, Wang Bingxue, Chen Han Y. H, Quan Quan, Chen Weinan, Yang Jilin, Meng Cheng, Wang Yi, Niu Shuli. 2020. Global variations and controlling factors of soil nitrogen turnover rate[J]. Earth−Science Reviews, 207: 103250. doi: 10.1016/j.earscirev.2020.103250
[75] Liao H K, Li Y Y, Yao H Y. 2018. Fertilization with inorganic and organic nutrients changes diazotroph community composition and N−fixation rates[J]. Soils Sediments, 18(3): 1076−1086. doi: 10.1007/s11368-017-1836-8
[76] Lin C Y, Wang Y X, Liu M H, Li Q, Xiao W F, Song X Z. 2020. Effects of nitrogen deposition and phosphorus addition on arbuscular mycorrhizal fungi of Chinese fir (Cunninghamia lanceolate)[J]. Scientific Reports, 10(1): 1−8. doi: 10.1038/s41598-019-56847-4
[77] Lin Wei, Fang Fuli, Zhang Wei, Ding Junjun, Li Yuzhong, Xu Chunying, Li Qiaozhen. 2017. A review on development of stable isotope technique in the studies of N2O formation mechanism[J]. Chinese Journal of Applied Ecology, 28(7): 2344−2352 (in Chinese with English abstract).
[78] Liu D W, Zhu W X, Wang X B, Pan P, Wang C, Xi D, Bai E, Wang S, Han X G, Fang Y T. 2017. Abiotic versus biotic controls on soil nitrogen cycling in drylands along a 3200 km transect[J]. Biogeosciences Discussions, (6): 1−26.
[79] Liu Junzheng. 2019. Soil Nitrogen Cycling Rate in Poyang Lake Wetland Under Different Drought Conditions[D]. Nanchang: Jiangxi Normal University, 1−64 (in Chinese with English abstract).
[80] Liu Q Y, Wang H M, Xu X L. 2020. Root nitrogen acquisition strategy of trees and understory species in a subtropical pine plantation in southern China[J]. European Journal of Forest Research, 139(5): 791−804. doi: 10.1007/s10342-020-01284-6
[81] Liu R, Hu H W, Suter H. 2016a. Nitrification is a primary driver of nitrous oxide production in laboratory microcosms from different land−use soils[J]. Frontiers in Microbiology, 7: 1373.
[82] Liu X J, Zhang Y, Han W X, Tang A H, Shen J L, Cui Z L, Vitousek P, Erisman J W, Goulding K, Christie P, Fangmeier A, Zhang F S. 2013. Enhanced nitrogen deposition over China[J]. Nature, 494(7438): 459−462. doi: 10.1038/nature11917
[83] Liu Y, He N P, Wen X F, Yu G R, Gao Y, Jia Y L. 2016b. Patterns and regulating mechanisms of soil nitrogen mineralization and temperature sensitivity in Chinese terrestrial ecosystems[J]. Agriculture Ecosystems & Environment, 215: 40−46.
[84] Lu M Z, Cheng S L, Fang H L, Xu M, Yang Y, Li Y N, Zhang J B, Müller C. 2021. Organic nitrogen addition causes decoupling of microbial nitrogen cycles by stimulating gross nitrogen transformation in a temperate forest soil[J]. Geoderma, 385: 114886. doi: 10.1016/j.geoderma.2020.114886
[85] Luo D H, Dong H, Luo H Y, Xian Y P, Wan J, Guo X D, Wu Y L. 2015b. The application of stable isotope ratio analysis to determine the geographical origin of wheat[J]. Food Chemistry, 174: 197−201. doi: 10.1016/j.foodchem.2014.11.006
[86] Luo T, Ouyang X Q, Yang L T, Li Y R, Song X P, Zhang G M , Gao Y J, Duan W X. 2015a. Benefit to growth of micropropagated sugarcane plants following inoculation with Klebsiella plantica[J]. International Sugar Journal, 117(1400): 564−568.
[87] Ma J, Bei Q C, Wang X J, Lan P, Liu G, Lin X W, Liu Q, Lin Z B, Liu B J, Zhang Y H. 2019. Impacts of Mo application on biological nitrogen fixation and diazotrophic communities in a flooded rice−soil system[J]. Science of the Total Environment, 649: 686−694. doi: 10.1016/j.scitotenv.2018.08.318
[88] Ma Xiuyan, Jiang Lei, Song Yanyu, Sun Li, Song Changchun, Hou Aixin, Gao Jinli, Du Yu. 2021. Effects of temperature and moisture changes on functional gene abundance of soil nitrogen cycle in permafrost peatland[J]. Acta Ecologica Sinica, 41(17): 6707−6717 (in Chinese with English abstract).
[89] Mao Chao, Qi Lianghua. 2015. Research advances on nitrogen transformation and cycling in forest soil[J]. World Forestry Research, 28(2): 8−13 (in Chinese with English abstract).
[90] Martin T S, Casciotti K L. 2016. Nitrogen and oxygen isotopic fractionation during microbial nitrite reduction[J]. Limnology & Oceanography, 61(3): 1134−1143.
[91] Martínez−Espinosa C, Sauvage S, Bitar A A, Green P A, Vörösmarty C J, Sánchez−Pérez J M. 2021. Denitrification in wetlands: A review towards a quantification at global scale[J]. Science of the Total Environment, 754: 142398. doi: 10.1016/j.scitotenv.2020.142398
[92] Martins D S, Reis V M, Schultz N, Bruno J R A, Urquiaga S, Pereira W, Sousa S J, Boddey M R. 2020. Both the contribution of soil nitrogen and of biological N2 fixation to sugarcane can increase with the inoculation of diazotrophic bacteria[J]. Plant and Soil, 454(1): 155−169.
[93] Mason R E, Craine J M, Lany N K, Jonard M, Ollinger S V, Groffman P M, Fulweiler R W, Angerer J, Read Q D, Reich P B, Templer P H, Elmore A J. 2022. Evidence, causes, and consequences of declining nitrogen availability in terrestrial ecosystems[J]. Science, 376(6590): 261.
[94] McLauchlan K K, Ferguson C J, Wilson I E, Ocheltree T W, Craine M J. 2010. Thirteen decades of foliar isotopes indicate declining nitrogen availability in central North American grasslands[J]. The New Phytologist, 187(4): 1135−1145. doi: 10.1111/j.1469-8137.2010.03322.x
[95] Miller A E, Bowman W D, Suding K N. 2007. Plant uptake of inorganic and organic nitrogen: Neighbor identity matters[J]. Ecology, 88(7): 1832−1840. doi: 10.1890/06-0946.1
[96] Nardi P, Akutsu M, Pariasca−Tanaka J, Wissuwa M. 2013. Effect of methyl 3−4−hydroxyphenyl propionate, a Sorghum root exudate, on N dynamic, potential nitrification activity and abundance of ammonia–oxidizing bacteria and archaea[J]. Plant and Soil, 367(1/2): 627−637.
[97] Nordin A, Högberg P, Näsholm T. 2001. Soil nitrogen form and plant nitrogen uptake along a boreal forest productivity gradient[J]. Oecologia, 129(1): 125−132. doi: 10.1007/s004420100698
[98] Oulimata D, Dahl K E, Madjiguene D A, Rostgaard N L, Vlastimil N, Diaminatou S, Holst L K, Kehlet H J, Anders R. 2022. Leaf morphology and stable isotope ratios of carbon and nitrogen in Acacia senegal (L. ) Wild trees vary with climate at the geographic origin and ploidy level[J]. Trees, 36(1): 295−312. doi: 10.1007/s00468-021-02206-8
[99] Pan B B, ZhangY S, Xia L L, Lam S K, Hu H W, Chen D L. 2022. Nitrous oxide production pathways in Australian forest soils[J]. Geoderma, 420: 115871. doi: 10.1016/j.geoderma.2022.115871
[100] Pan Y P, Tian S L, Liu D W, Fang Y T, Zhu X Y, Zhang Q, Zheng B, Michalski G, Wang Y S. 2016. Fossil fuel combustion−related emissions dominate atmospheric ammonia sources during severe haze episodes: Evidence from 15N−stable isotope in size−resolved aerosol ammonium[J]. Environmental Science & Technology, 50(15): 8049−56.
[101] Park H J, Baek N, Lim S S, Jeong Y G, Seo B S, Kwak J H, Lee S M, Yun S I, Kim H Y, Muhammad A. 2023. Coupling of δ13C and δ15N to understand soil organic matter sources and C and N cycling under different land−uses and management: A review and data analysis[J]. Biology and Fertility of Soils, 59(5): 487−499. doi: 10.1007/s00374-022-01668-3
[102] Park S, Croteau P, Boering K A, Etheridge D M, Ferretti D, Fraser P J, Kim K R, Krummel P B, Langenfelds R L, van Ommen T D, Steele L P, Trudinger C M. 2012. Trends and seasonal cycles in the isotopic composition of nitrous oxide since 1940[J]. Nature Geoscience, 5(4): 261−265. doi: 10.1038/ngeo1421
[103] Parnell A C, Inger R, Bearhop S, Jackson A L. 2010. Source partitioning using stable isotopes: Coping with too much variation[J]. PLoS One, 5(3): 1−5.
[104] Phillips D L, Koch P L. 2002. Incorporating concentration dependence in stable isotope mixing models[J]. Oecologia, 130(1): 114−125. doi: 10.1007/s004420100786
[105] Rittenberg D, Keston A S, Rosebury F, Schoenheimer R. 1939. Studies in protein metabolism Ⅱ The determinatson of nitro gen isotopes in organic compound[J]. The Jounal of Biological Chemistry, 127(1): 291−299. doi: 10.1016/S0021-9258(18)73841-6
[106] Rohe L, Well R, Lewicka−Szczebak D. 2017. Use of oxygen isotopes to differentiate between nitrous oxide produced by fungi or bacteria during denitrification[J]. Rapid Communications in Mass Spectrometry, 31(16): 1297−1312. doi: 10.1002/rcm.7909
[107] Rossiter−Rachor N A, Setterfield S A, Douglas M M, HutleyL B, Cook G D, Schmidt S. 2009. Invasive Andropogon gayanus (gamba grass) is an ecosystem transformer of nitrogen relations in Australian savanna[J]. Ecological Applications, 19(6): 1546−1560. doi: 10.1890/08-0265.1
[108] Rui Y C, Wang S P, Xu Z H, Wang Y , Chen, C R, Zhou X Q, Kang X M, Lu S B, Hu Y G, Lin Q Y, Luo C Y. 2011. Warming and grazing afect soil labile carbon and nitrogen pools diferently in an alpine meadow of the Qinghai−Tibet Plateau in China[J]. Soils Sediments, 11(6): 903−914.
[109] Sankoh A A, Derkyi N S A, Frazer−williams R A D, Laar C, Kamara I. 2022. A review on the application of isotopic techniques to trace groundwater pollution sources within developing countries[J]. Water, 14(35): 35.
[110] Schwede D B, Simpson D, Tan J, Fu J S, Dentener F, Du E, deVries W. 2018. Spatial variation of modelled total, dry and wet nitrogen deposition to forests at global scale[J]. Environmental Pollution, 243: 1287−1301. doi: 10.1016/j.envpol.2018.09.084
[111] Shen J X, Aubrey L Z, Mark W C. 2022. Nitrogen cycling and biosignatures in a hyperarid mars analog environment[J]. Astrobiology, 22(2): 127−142. doi: 10.1089/ast.2021.0012
[112] Silva A, Franzini V I, Piccolla C D, Muraoka T. 2017. Molybdenum supply and biological fixation of nitrogen by two Brazilian common bean cultivars[J]. Revista Brasileira de Engenharia Agrícola e Ambiental, 21(2): 100−105.
[113] Skjemstad J O, Taylor J A, Janik L J, Marvanek S P. 1999. Soil organic carbon dynamics under long−term sugarcane monoculture[J]. Australian Journal of Soil Research, 37: 151−164. doi: 10.1071/S98051
[114] Song W, Liu X Y, Liu C Q. 2021. New constraints on isotopic effects and major sources of nitrate in atmospheric particulates by combining δ15N and Δ17O signatures[J]. Journal of Geophysical Research: Atmospheres, 126(16): 2169−897X.
[115] Søvik A K, Mørkved P T. 2008. Use of stable nitrogen isotope fractionation to estimate denitrification in small constructed wetlands treating agricultural runoff[J]. Science of the Total Environment, 392(1): 157−165. doi: 10.1016/j.scitotenv.2007.11.014
[116] Su C X, Kang R H, Zhu W X, Huang W T, Song L L, Wang A, Liu D W, Quan Z, Zhu F F, Fu P Q, Fang Y T. 2020. δ15N of nitric oxide produced under aerobic or anaerobic conditions from seven soils and their associated N isotope fractionations[J]. Journal of Geophysical Research: Biogeosciences, 125(9): 1−18.
[117] Suzuki Y. 2021. Achieving Food Authenticity and Traceability using an Analytical Method Focusing on Stable Isotope Analysis[J]. Analytical sciences: The international journal of the Japan Society for Analytical Chemistry, 37(1): 189−199.
[118] Tao K, Kelly S, Radutoiu S. 2019. Microbial associations enabling nitrogen acquisition in plants[J]. Current Opinion in Microbiology, 49: 83−89. doi: 10.1016/j.mib.2019.10.005
[119] Taousa F, Amenzoua N, Marah H, Maia R, Maguas C, Bahmad L, Kelly S. 2020. Stable isotope ratio analysis as a new tool to trace the geographical origin of Argan oils in Morocco[J]. Forensic Chemistry, 17: 2468−1709.
[120] Templer P H, Mack M C, Chapin III F S, Christenson L M, Compton J E, Crook H D, Currie W S, Curtis C J, Dail D B, D'Antonio C M, Emmet B A, Epstein H E, Goodale C L, Gundersen P, Hobble S E, Holland K, Hooper D U, Hungate B A, Lamontagne S, Nadelhoffer K J. 2012. Sinks for nitrogen inputs in terrestrial ecosystems: A meta−analysis of 15N tracer field studies[J]. Ecology, 93(8): 1816−1829. doi: 10.1890/11-1146.1
[121] Tharayil N, Alpert P, Bhowmik P, Gerard P. 2013. Phenolic inputs by invasive species could impart seasonal variations in nitrogen[J]. Soil Biology and Biochemistry, 57: 858−867. doi: 10.1016/j.soilbio.2012.09.016
[122] Thorpe A S, Callaway R M. 2011. Biogeographic differences in the effects of Centaurea stoebe on the soil nitrogen cycle: Novel weapons and soil microbes[J]. Biological Invasions, 13(6): 1435−1445. doi: 10.1007/s10530-010-9902-9
[123] Tian H Q, Xu R T, Canadell J G, Thompson R L, Winiwarter W, Suntharalingam P, Davidson E A, Ciais P, Jackson R B, Janssens−Maenhout G, Prather M J, Regnier P, Pan N Q, Pan S F, Peters G P, Shi H, Tubiello F N, Zaehle S, Zhou F, Arneth A, Battaglia G, Berthet S, Bopp L, Bouwman A F, Buitenhuis E T, Chang J F, Chipperfield M P, Dangal S R S, Dlugokencky E, Elkins J W, Eyre B D, Fu B J, Hall B, Ito A, Joos F, Krummel P B, Landolfi A, Laruelle G G, Lauerwald R, Li W, Lienert S, Maavara T, MacLeod M, Millet D B, Olin S, Patra P K, Prinn R G, Raymond P A, Ruiz D J, van der Werf G R, Vuichard N, Wang J J, Weiss R F, Wells K C, Wilson C, Yang J, Yao Y Z. 2020. A comprehensive quantification of global nitrous oxide sources and sinks[J]. Nature, 586(7828): 248. doi: 10.1038/s41586-020-2780-0
[124] Treibergs L A, Granger J. 2017. Enzyme level N and O isotope effects of assimilatory and dissimilatory nitrate reduction[J]. Limnology & Oceanography, 62(1): 272−288.
[125] Van Deynze A, Zamora P, Pierre−Marc Delaux. 2018. Nitrogen fixation in a landrace of maize is supported by a mucilage−associated diazotrophic microbiota[J]. PLOS Biology, 16(8): e2006352. doi: 10.1371/journal.pbio.2006352
[126] Wang A, Chen D X, Phillips O L, Gundersen P, Zhou X L, Gurmesa G A, Li S L, Zhu W X, Hobbie E A, Wang X Y, Fang Y T. 2021. Dynamics and multi−annual fate of atmospherically deposited nitrogen in montane tropical forests[J]. Global Change Biology 27(10): 2076−2087.
[127] Wang A, Fang Y T, Chen D X, Phillips O, Koba K. 2018. High nitrogen isotope fractionation of nitrate during denitrification in four forest soils and its implications for denitrification rate estimates[J]. Science of the Total Environment, 633(1): 1078−1088.
[128] Wang H, Yan Z F, Ju X T, Song X T, Zhang J B, Li S L, Barker X Z. 2023. Quantifying nitrous oxide production rates from nitrification and denitrification under various moisture conditions in agricultural soils: Laboratory study and literature synthesis[J]. Frontiers in Microbiology, 13: 1110151. doi: 10.3389/fmicb.2022.1110151
[129] Wang J, Cheng Y, Zhang J B, Müeller C, Cai Z C. 2016. Soil gross nitrogen transformations along a secondary succession transect in the north subtropical forest ecosystem of southwest China[J]. Geoderma, 280(1): 88−95.
[130] Wang J, Zhu B, Zhang J B, Müller C, Cai Z C. 2015. Mechanisms of soil N dynamics following long−term application of organic fertilizers to subtropical rain−fed purple soil in China[J]. Soil Biology & Biochemistry, 91: 222−231.
[131] Wang Keyi, Liu Xiaohong, Zeng Xiaomin, Xu Guobao, Zhang Lingnan, Li Chunyue. 2021. Stable nitrogen isotope in tree rings: Progresses, problems and prospects[J]. Acta Geographica Sinica, 76(5): 1193−1205 (in Chinese with English abstract).
[132] Wang L, Macko S A. 2011. Constrained preferences in nitrogen uptake across plant species and environments[J]. Plant, Cell & Environment, 34(3): 525−534.
[133] Wang Liming, Wu Hao, Lin Guanghui. 2015. Progresses in applications of stable isotope technology to determining geographical origins of traditional Chinese medicines[J]. Journal of Isotopes, 28(4): 225−232 (in Chinese with English abstract).
[134] Waser N A D, Harrison P J, Nielsen B, Calvert S E, Turpin D H. 1998. Nitrogen isotope fractionation during the uptake and assimilation of nitrate, nitrite, ammonium, and urea by a marine diatom[J]. Limnology and Oceanography, 43(2): 215−224. doi: 10.4319/lo.1998.43.2.0215
[135] Well R, Eschenbach W, Flessa H, Heide C V D, Weymann D. 2012. Are dual isotope and isotopomer ratios of N2O useful indicators for N2O turnover during denitrification in nitrate−contaminated aquifers?[J]. Geochimica et Cosmochimica Acta, 90(1): 265−282.
[136] Wells N S, Baisden W T, Clough T J. 2015. Ammonia volatilization is not the dominant factor in determining the soil nitrate isotopic composition of pasture systems[J]. Agriculture Ecosystems & Environment, 199: 290−300.
[137] Widory D, Petelet−Giraud E, Brenot A, Bronders J, Tirez K, Boeckx P. 2013. Improving the management of nitrate pollution in water by the use of isotope monitoring: The δ15N, δ18O and δ11B triptych[J]. Isotopes in Environmental & Health Studies, 49(1): 29−47.
[138] Wrage−Mönnig N, Horn M A, Well R, Müller C, Velthof G, Oenema O. 2018. The role of nitrifier denitrification in the production of nitrous oxide revisited[J]. Soil Biology and Biochemistry, 123: A3−A16. doi: 10.1016/j.soilbio.2018.03.020
[139] Wu Y L, Luo D H, Dong H, Wan J, Luo H Y, Xian Y P, Guo X D, Qin F F, Han W Q, Wang L, Wang B. 2015. Geographical origin of cereal grains based on element analyser−stable isotope ratio mass spectrometry (EA−SIRMS)[J]. Food Chemistry, 174: 553−557. doi: 10.1016/j.foodchem.2014.11.096
[140] Xie Xianjun. 2019. Principles and Applications of Environmental Isotopes[M]. Beijing: Science Press (in Chinese).
[141] Xiu L Q, Zhang W M, Wu D, Sun Y Y, Zhang H G, Gu W Q, Wang Y N, Meng J, Chen W F. 2021. Biochar can improve biological nitrogen fixation by altering the root growth strategy of soybean in Albic soil[J]. Science of the Total Environment, 773: 144564. doi: 10.1016/j.scitotenv.2020.144564
[142] Xue D M, Botte J, De Baets B, Accoe F, Nestler A, Taylor P, Van Cleemput O, Berglund M, Boeckx P. 2009. Present limitations and future prospects of stable isotope methods for nitrate source identification in surface−and groundwater[J]. Water Research, 43(5): 1159−1170. doi: 10.1016/j.watres.2008.12.048
[143] Yang L P, Han J P, Xue J L, Zeng L Z, Shi J C, Wu L S, Jiang Y H. 2013. Nitratesource apportionment in a subtropical watershed using Bayesian model[J]. Science of the Total Environment, 463−464(13): 340−347.
[144] Yang W H, McDowell A C, Brooks P D, Silver W L. 2014. New high precision approach for measuring 15N−N2 gas fluxes from terrestrial ecosystems[J]. Soil Biology & Biochemistry, 69: 234−241.
[145] Yao Fanyun, Zhu Biao, Du Enzai. 2015. Use of 15N natural abundance in nitrogen cycling of terrestrial ecosystems[J]. Chinese Journal of Plant Ecology, 36(4): 346−352 (in Chinese with English abstract).
[146] You Chongshao, Li Yugui, Liu Donglai, Hu Yimin, Ling Mingde. 1965. Mass spectrometry analysis of 15N in biological samples. Atomic Energy, 6: 535−542 (in Chinese).
[147] Yun S I, Ro S I, Choi W J, Han G H. 2011. Interpreting the temperature−induced response of ammonia oxidizing microorganisms in soil using nitrogen isotope fractionation[J]. Journal of Soils & Sediments, 11(7): 1253−1261.
[148] Yun S I, Ro S I. 2014. Can nitrogen isotope fractionation reveal ammonia oxidation responses to varying soil moisture?[J]. Soil Biology & Biochemistry, 76: 136−139.
[149] Zan Qilin, Lai Xiaoming, Zhu Qing, Wang Weiguang, Li Liuyang, Liu Ya. 2022. Study on factors Influencing spatial variation of soil 15N Natural Abundance on Global Scale[J]. Soils, 54(5): 920−927 (in Chinese).
[150] Zendehbad M, Cepuder P, Loiskandl W, Stumpp C. 2019. Source identification of nitrate contamination in the urban aquifer of Mashhad, Iran[J]. Journal of Hydrology: Regional Studies, 25: 100618. doi: 10.1016/j.ejrh.2019.100618
[151] Zhang J B, Müller C, Cai Z C. 2015b. Heterotrophic nitrification of organic N and its contribution to nitrous oxide emissions in soils[J]. Soil Biology & Biochemistry, 84: 199−209.
[152] Zhang J B, Wang L, Zhao W, Hu H F, Feng X J, Müller C, Cai Z C. 2016a. Soil gross nitrogen transformations along the Northeast China Transect (NECT) and their response to simulated rainfall events[J]. Scientific Reports, 6(3): 22830−22830.
[153] Zhang J, Cai Z, Müller C. 2018. Terrestrial N cycling associated with climate and plant specific N preferences: A review[J]. European Journal of Soil Science, 69(3): 488−501.
[154] Zhang Jinbo, Dai Shenyan, Wen Teng, Cai Zucong. 2022. Principle and Application of Stable Isotope Tracer of Carbon and Nitrogen[M]. Beijing: Science Press (in Chinese).
[155] Zhang L Y, Zhang M L, Huang S Y, Li L J, Gao Q, Wang Y, Zhang S Q, Huang S M, Yuan L, Wen Y C, Liu K L, Yu X C, Li D C, Zhang L, Xu X P, Wei H L, He P, Zhou W, Philippot L, Ai C. 2022. A highly conserved core bacterial microbiota with nitrogen−fixation capacity inhabits the xylem sap in maize plants[J]. Nature Communications, 13(1): 1−13. doi: 10.1038/s41467-021-27699-2
[156] Zhang W, Li Y Z, Xu C Y, Li Q Z, Lin W. 2016b. Isotope signatures of N2O emitted from vegetable soil: Ammonia oxidation drives N2O production in NH4+−fertilized soil of North China[J]. Scientific Reports, 6: 29257. doi: 10.1038/srep29257
[157] Zhang Y S, Zhang J B, Zhu T B, Müller C, Cai Z C. 2015a. Effect of orchard age on soil nitrogen transformation in subtropical China and implications[J]. Acta Scientiae Circumstantiae, (8): 10−19.
[158] Zhang Y, Li F D, Zhang Q Y, Li J, Liu Q. 2014. Tracing nitrate pollution sources and transformation in surface and ground−waters using environmental isotopes[J]. The Science of the Total Environment, 490: 213−222. doi: 10.1016/j.scitotenv.2014.05.004
[159] Zhang Y, Shi P, Song J X, Li Q. 2019. Application of nitrogen and oxygen isotopes for source and fate identification of nitrate pollution in surface water: A review[J]. Applied Sciences, 9(1): 18.
[160] Zhang Y, Zhao J, Huang X Q, Cheng Y, Cai Z C, Zhang J B, Müller C. 2021. Microbial pathways account for the pH effect on soil N2O production[J]. European Journal of Soil Biology, 106: 103337. doi: 10.1016/j.ejsobi.2021.103337
[161] Zhang Y, Zhao W, Zhang J B, Cai Z C. 2017. N2O production pathways relate to land use type in acidic soils in subtropical China[J]. Journal of Soil & Sediments, 17(2): 306−314.
[162] Zhang Yanhui, Hu Tianlong, Wang Hui, Jin Haiyang, Liu Benjuan, Liu Hongtao, Liu Qi, Lin Zhibin, Lin Xingwu, Xie Zubin. 2021. Effects of rice planting on nitrogen fixation amount and activity in paddy field using 15N2 direct labeling method[J]. Soils, 53(4): 739−745 (in Chinese with English abstract).
[163] Zhang Zhijun, Qin Shuping, Yuan Haijing, Zhang Yuming, Hu Chunsheng. 2018. Advance in soil dinitrogen emission[J]. Chinese Journal of Eco−Agriculture, 26(2): 182−189 (in Chinese with English abstract).
[164] Zheng Yongfei, Chen Jiangfeng. 2000. Stable Isotope Geochemistry [M]. Beijing: Science Press (in Chinese).
[165] Zhou J, Shao G D, Kumar A, Shi L, Kuzyakov Y, Pausch J. 2022. Carbon fuxes within tree−crop−grass agroforestry system: 13C labeling and tracing[J]. Biology and Fertility of Soils, 58(7): 733−743. doi: 10.1007/s00374-022-01659-4
[166] Zhou M X, Yan G Y, Xing Y J, Chen F, Zhang X, Wang J Y, Zhang J H, Dai G H, Zheng X B, Sun W J. 2019. Nitrogen deposition and decreased precipitation does not change total nitrogen uptake in a temperate forest[J]. Science of the Total Environment, 651(1): 32−41.
[167] Zhu F F, Dai L M, Hobbie E A. 2019. Uptake patterns of glycine, ammonium, and nitrate differ among four common tree species of northeast china[J]. Frontiers in Plant Science, 10: 799. doi: 10.3389/fpls.2019.00799
[168] Zong Yi, Huang Qiaoqiao, Li Xiaoxia, Fan Zhiwei, Shen Yide. 2015. Spread and explosion of Merremia boisiana on physical and chemical properties and enzyme activity in soil ecosystem[J]. Guangdong Agricultural Sciences, 42(1): 42−45 (in Chinese with English abstract).
[169] 曹亚澄, 张金波, 温腾. 2018. 稳定同位素示踪技术与质谱分析在土壤、生态、环境研究中的应用[M]. 北京: 科学出版社. [170] 冯晓敏, 高翔, 臧华栋, 胡跃高, 任长忠, 郝志萍, 吕慧卿, 曾昭海. 2023. 燕麦−绿豆间作效应及氮素转移特性[J]. 植物学报, 58(1): 122−131. doi: 10.11983/CBB22176 [171] 黄乔乔, 许慧, 范志伟, 侯玉平. 2013. 火炬树入侵黑松幼林过程中对土壤化学性质的影响[J]. 生态环境学报, 22(7): 1119−1123. doi: 10.3969/j.issn.1674-5906.2013.07.005 [172] 李思亮, 刘丛强, 肖化云. 2002. 地表环境氮循环过程中微生物作用及同位素分馏研究综述[J]. 地质地球化学, 30(4): 40−45. [173] 林伟, 房福力, 张薇, 丁军军, 李玉中, 徐春英, 李巧珍. 2017. 稳定同位素技术在土壤N2O溯源研究中的应用[J]. 应用生态学报, 28(7): 2344−2352. [174] 刘君政. 2019. 不同干旱条件下鄱阳湖湿地土壤氮循环速率[D]. 南昌: 江西师范大学, 1−64. [175] 马秀艳, 蒋磊, 宋艳宇, 孙丽, 宋长春, 侯爱新, 高晋丽, 杜宇. 2021. 温度和水分变化对冻土区泥炭地土壤氮循环功能基因丰度的影响[J]. 生态学报, 41(17): 6707−6717. [176] 毛超, 漆良华. 2015. 森林土壤氮转化与循环研究进展[J]. 世界林业研究, 28(2): 8−13 [177] 王可逸, 刘晓宏, 曾小敏, 徐国保, 张凌楠, 李春越. 2021. 树轮稳定氮同位素记录的进展与展望[J]. 地理学报, 76(5): 1193−1205. doi: 10.11821/dlxb202105011 [178] 王黎明, 吴浩, 林光辉. 2015. 稳定同位素技术在中药产地溯源方面的应用研究进展[J]. 同位素, 28(4): 225−232. doi: 10.7538/tws.2015.28.04.0225 [179] 谢先军. 2019. 环境同位素原理与应用[M]. 北京: 科学出版社. [180] 姚凡云, 朱彪, 杜恩在. 2015. 15N自然丰度法在陆地生态系统氮循环研究中的应用[J]. 植物生态学报, 36(4): 346−352. [181] 尤崇杓, 李玉桂, 刘东来, 胡铁民, 凌明德. 1965. 生物样本中15N的质谱分析[J]. 原子能, 6: 535−542. [182] 昝麒麟, 赖晓明, 朱青, 王卫光, 李柳阳, 刘亚. 2022. 全球尺度上土壤15N自然丰度空间变化的影响因素[J]. 土壤, 54(5): 920−927. [183] 张金波, 戴沈燕, 温腾, 蔡祖聪. 2022. 碳氮稳定同位素示踪原理与应用[M]. 北京: 科学出版社. [184] 张燕辉, 胡天龙, 王慧, 靳海洋, 刘本娟, 刘红涛, 刘琦, 林志斌, 蔺兴武, 谢祖彬. 2021. 利用15N2直接标记法研究水稻种植对稻田固氮量和固氮活性的影响[J]. 土壤, 53(4): 739−745. [185] 张志君, 秦树平, 袁海静, 张玉铭, 胡春胜. 2018. 土壤氮气排放研究进展[J]. 中国生态农业学报, 26(2): 182−189. [186] 郑永飞, 陈江峰. 2000. 稳定同位素地球化学[M]. 北京: 科学出版社. [187] 纵熠, 黄乔乔, 李晓霞, 范志伟, 沈奕德. 2015. 金钟藤蔓延成灾对土壤理化性质及土壤酶活性的影响[J]. 广东农业科学, 42(1): 42−45. doi: 10.3969/j.issn.1004-874X.2015.01.010 -
期刊类型引用(0)
其他类型引用(3)



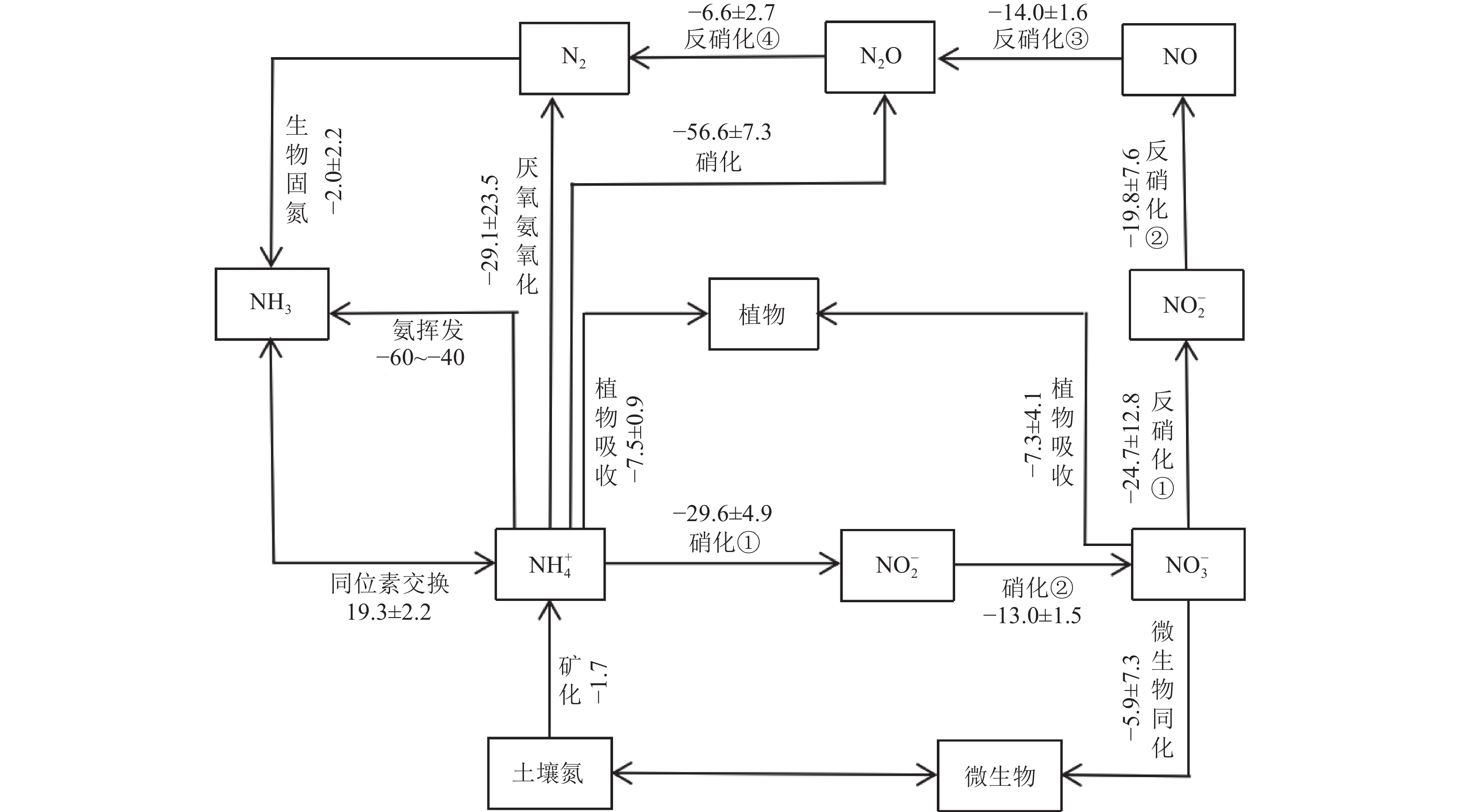
 下载:
下载: